Tiempo de lectura estimado: 3 minutos
El termómetro de Beckman fue desarrollado por el químico alemán Ernst Otto Beckmann para medir las pequeñas diferencias en las temperaturas de fusión y ebullición que se presentan debido a las propiedades coligativas de las soluciones.
Un termómetro de Beckmann es un dispositivo utilizado para medir pequeñas diferencias de temperatura, pero no los valores absolutos de temperatura. Fue inventado por Ernst Otto Beckmann (1853 – 1923), un químico alemán, para sus mediciones de las propiedades coligativas en 1905. Hoy en día su uso ha sido ampliamente reemplazado por los termómetros electrónicos.
Descripción del termómetro de Beckmann
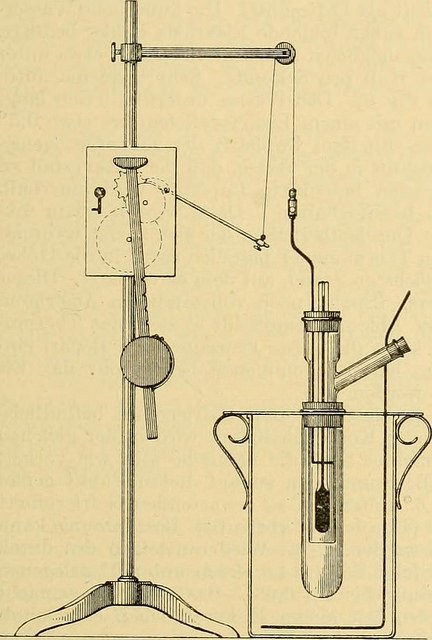
La longitud de un termómetro Beckmann es generalmente de 40 a 50 cm. La escala de temperatura típicamente cubre unos 5 °C y se divide en centésimas de grado. Con una lupa es posible estimar los cambios de temperatura en 0,001 °C. La peculiaridad del diseño del termómetro de Beckmann es un depósito (R en el diagrama) en el extremo superior del tubo, mediante el cual la cantidad de mercurio en el bulbo puede aumentarse o disminuirse, de modo que el instrumento puede configurarse para medir las diferencias de temperatura a valores de temperatura altos o bajos. Por el contrario, el rango de un termómetro típico de mercurio en vidrio es fijo, siendo fijado por las marcas de calibración grabadas en el vidrio o las marcas de la escala impresa.

Calibración
Al ajustar el termómetro, debe dejarse una cantidad suficiente de mercurio en el bulbo y el tallo para dar lecturas entre las temperaturas requeridas. Primero, el termómetro se invierte y se golpea suavemente para que el mercurio del depósito se aloje en la curva (B) del extremo de la varilla. Luego, el bulbo se calienta hasta que el mercurio del tallo se une al mercurio del depósito. El termómetro se coloca entonces en una bañera uno o dos grados por encima del límite superior de las temperaturas a medir.
Se golpea suavemente el extremo superior del tubo con el dedo, y el mercurio suspendido en la parte superior del depósito se sacudirá hacia abajo, separándolo así de la rosca en la curva (B). El termómetro se ajustará entonces para las lecturas entre las temperaturas requeridas.
Para más información «Modifikation des Thermometers für die bestimmung von Molekulargewichten und kleinen Temperaturdifferenzen»
Como citar este artículo:
APA: (2019-04-01). Termómetro de Beckmann. Recuperado de https://quimicafacil.net/infografias/material-de-laboratorio/termometro-de-beckmann/
ACS: . Termómetro de Beckmann. https://quimicafacil.net/infografias/material-de-laboratorio/termometro-de-beckmann/. Fecha de consulta 2025-10-23.
IEEE: , "Termómetro de Beckmann," https://quimicafacil.net/infografias/material-de-laboratorio/termometro-de-beckmann/, fecha de consulta 2025-10-23.
Vancouver: . Termómetro de Beckmann. [Internet]. 2019-04-01 [citado 2025-10-23]. Disponible en: https://quimicafacil.net/infografias/material-de-laboratorio/termometro-de-beckmann/.
MLA: . "Termómetro de Beckmann." https://quimicafacil.net/infografias/material-de-laboratorio/termometro-de-beckmann/. 2019-04-01. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net