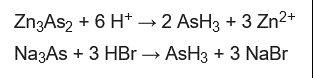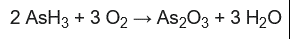Tiempo de lectura estimado: 9 minutos
La arsina (nombre IUPAC: arsano) es un compuesto inorgánico con la fórmula AsH3. Este gas hidruro pnicógeno, inflamable y altamente tóxico, es uno de los compuestos más simples del arsénico. A pesar de su letalidad, encuentra algunas aplicaciones en la industria de los semiconductores y para la síntesis de compuestos organoarsénicos. El término arsina se utiliza habitualmente para describir una clase de compuestos organoarsénicos de la fórmula AsH3-xRx, donde R = arilo o alquilo. Por ejemplo, el As(C6H5)3, llamado trifenilarsina, se denomina «una arsina».
Características de la arsina
En su estado estándar, la arsina es un gas incoloro, más denso que el aire, que es ligeramente soluble en agua (20% a 20 °C) y también en muchos disolventes orgánicos. Mientras que la arsina en sí misma es inodora, debido a su oxidación por el aire, es posible oler un ligero olor a ajo o a pescado cuando el compuesto está presente por encima de 0,5 ppm. Este compuesto es cinéticamente estable: a temperatura ambiente se descompone lentamente. A temperaturas de unos 230 °C, la descomposición en arsénico e hidrógeno es lo suficientemente rápida como para ser la base de la prueba de Marsh. Al igual que la estibina, la descomposición de la arsina es autocatalítica, ya que el arsénico liberado durante la reacción actúa como catalizador de la misma. Otros factores, como la humedad, la presencia de luz y ciertos catalizadores (concretamente la alúmina) facilitan la velocidad de descomposición.
El AsH3 es una molécula piramidal con ángulos H-As-H de 91,8° y tres enlaces As-H equivalentes, cada uno de 1,519 Å de longitud.
Descubrimiento y síntesis
En 1775, Carl Scheele reportó su descubrimiento cuando redujo el óxido de arsénico (III) con zinc en presencia de ácido. Esta reacción es un preludio de la prueba de Marsh.
El AsH3 se prepara generalmente por la reacción de fuentes de As3+ con equivalentes de H–.
Alternativamente, las fuentes de As3- reaccionan con reactivos protónicos para producir también este gas. El arseniuro de zinc y el arseniuro de sodio son precursores adecuados:
Comportamiento químico de la arsina
La comprensión de las propiedades químicas del AsH3 está bien desarrollada y puede anticiparse basándose en un promedio del comportamiento de homólogos pnicógenos más ligeros, como el PH3 y el SbH3.
Descomposición térmica
Típico de un hidruro pesado, la arsina es inestable con respecto a sus elementos. En otras palabras, el AsH3 es estable cinéticamente pero no termodinámicamente.
Esta reacción de descomposición es la base de la prueba Marsh, que detecta el As elemental.
Oxidación
Siguiendo la analogía con el SbH3, el AsH3 se oxida fácilmente con oxígeno concentrado o con la concentración de oxígeno diluido en el aire:
La arsina reacciona violentamente en presencia de agentes oxidantes fuertes, como el permanganato de potasio, el hipoclorito de sodio o el ácido nítrico.
Precursor de derivados metálicos
El AsH3 se utiliza como precursor de complejos metálicos de As «desnudo» (o «casi desnudo»). Un ejemplo es la especie de dimanganeso [(C5H5)Mn(CO)2]2AsH, en la que el núcleo de Mn2AsH es planar.
Prueba de Gutzeit
Una prueba característica del arsénico consiste en la reacción del AsH3 con el Ag+, denominada prueba de Gutzeit para el arsénico. Aunque esta prueba ha quedado obsoleta en la química analítica, las reacciones subyacentes ilustran aún más la afinidad del AsH3 por los cationes metálicos «blandos». En la prueba de Gutzeit, el AsH3 se genera mediante la reducción de compuestos acuosos de arsénico, normalmente arsenitos, con Zn en presencia de ácido sulfúrico. El AsH3 gaseoso resultante se expone al AgNO3, ya sea en forma de polvo o de solución. Con el AgNO3 sólido, el AsH3 reacciona para producir Ag4AsNO3 amarillo, mientras que el AsH3 reacciona con una solución de AgNO3 para dar Ag3As negro.
Reacciones ácido-base de la arsina
A menudo se aprovechan las propiedades ácidas del enlace As-H. Así, el AsH3 puede ser desprotonado:
Al reaccionar con los trialquilos de aluminio, el AsH3 da el trimérico [R2AlAsH2]3, donde R = (CH3)3C. Esta reacción es relevante para el mecanismo por el que se forma el GaAs a partir del AsH3.
La arsina se considera generalmente no básica, pero puede ser protonada por superácidos para dar sales aislables de la especie tetraédrica [AsH4]+.
Reacción con compuestos halógenos
Las reacciones de la arsina con los halógenos (flúor y cloro) o algunos de sus compuestos, como el tricloruro de nitrógeno, son extremadamente peligrosas y pueden provocar explosiones.
Formación de cadenas
A diferencia del comportamiento del PH3, el AsH3 no forma cadenas estables, aunque se han detectado H2As-AsH2 e incluso H2As-As(H)-AsH2. La diarsina es inestable por encima de -100 °C.
Usos de la arsina
El AsH3 se utiliza en la síntesis de materiales semiconductores relacionados con la microelectrónica y los láseres de estado sólido. Relacionado con el fósforo, el arsénico es un dopante n para el silicio y el germanio. Más importante aún, la arsina se utiliza para fabricar el semiconductor GaAs mediante deposición química de vapor (CVD) a 700-900 °C:
Para las aplicaciones microelectrónicas, la arsina puede suministrarse a través de una fuente de gas subatmosférica. En este tipo de paquete de gas, la arsina se adsorbe en un adsorbente sólido microporoso dentro de un cilindro de gas.
Este método permite almacenar el gas sin presión, reduciendo significativamente el riesgo de una fuga de gas arsina del cilindro. Con este aparato, la arsina se obtiene aplicando vacío a la salida de la válvula del cilindro de gas. Para la fabricación de semiconductores, este método es factible, ya que procesos como la implantación de iones operan bajo alto vacío.
Desde antes de la Segunda Guerra Mundial se propuso a la arsina como posible arma de guerra química. El gas es incoloro, casi inodoro, y 2,5 veces más denso que el aire, como se requiere para un efecto de cobertura buscado en la guerra química. Además, es letal en concentraciones muy inferiores a las necesarias para percibir su aroma a ajo.
A pesar de estas características, la arsina nunca se utilizó oficialmente como arma, debido a su alta inflamabilidad y a su menor eficacia en comparación con la alternativa no inflamable del fosgeno. Por otro lado, se han desarrollado eficazmente varios compuestos orgánicos basados en la arsina, como la lewisita (β-clorovinildicloroarsina), la adamsite (difenilaminecloroarsina), la Clark 1 (difenilcloroarsina) y la Clark 2 (difenilcianoarsina) para su uso en la guerra química.
Prueba de Marsh
El AsH3 también es bien conocido en la ciencia forense porque es un intermediario químico en la detección del envenenamiento por arsénico. La antigua (pero extremadamente sensible) prueba de Marsh genera AsH3 en presencia de arsénico. Este procedimiento, publicado en 1836 por James Marsh, se basa en el tratamiento de una muestra del cuerpo de una víctima que contenga As (normalmente el contenido del estómago) con zinc libre de arsenico y ácido sulfúrico diluido: si la muestra contiene arsénico, se formará arsina gaseosa. El gas se conduce por un tubo de vidrio y se descompone mediante calentamiento a unos 250-300 °C. La presencia de As se indica por la formación de un depósito en la parte calentada del equipo. Por otro lado, la aparición de un depósito de espejo negro en la parte fría del equipo indica la presencia de antimonio (el altamente inestable SbH3 se descompone incluso a bajas temperaturas).
La prueba Marsh se utilizó ampliamente a finales del siglo XIX y principios del XX; hoy en día se emplean técnicas más sofisticadas como la espectroscopia atómica, el plasma acoplado inductivamente y el análisis de fluorescencia de rayos X en el ámbito forense. Aunque el análisis por activación de neutrones se utilizó para detectar niveles de trazas de arsénico a mediados del siglo XX, desde entonces ha caído en desuso en la medicina forense moderna.
Para más información Arsine
Como citar este artículo:
APA: (2022-02-22). Arsina. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/arsina/
ACS: . Arsina. https://quimicafacil.net/compuesto-de-la-semana/arsina/. Fecha de consulta 2024-07-27.
IEEE: , "Arsina," https://quimicafacil.net/compuesto-de-la-semana/arsina/, fecha de consulta 2024-07-27.
Vancouver: . Arsina. [Internet]. 2022-02-22 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/arsina/.
MLA: . "Arsina." https://quimicafacil.net/compuesto-de-la-semana/arsina/. 2022-02-22. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net