Actualizado en enero 10, 2024
Tiempo de lectura estimado: 4 minutos
El ácido clorhídrico, también conocido como ácido muriático, es una solución acuosa de cloruro de hidrógeno. Es una solución incolora con un olor penetrante característico. Se clasifica como un ácido fuerte. Es un componente del ácido gástrico en los sistemas digestivos de la mayoría de las especies animales, incluido el ser humano. El ácido clorhídrico es un importante reactivo de laboratorio y producto químico industrial.
¿Como se sintetiza el ácido clorhídrico?
El ácido clorhídrico suele prepararse industrialmente mediante la disolución de cloruro de hidrógeno en agua. El cloruro de hidrógeno puede generarse de muchas maneras, por lo que existen varios precursores del ácido clorhídrico. La producción a gran escala de ácido clorhídrico está casi siempre integrada con la producción a escala industrial de otros productos químicos, como en el proceso cloroalcalino que produce hidróxido, hidrógeno y cloro, este último puede combinarse para producir HCl.
Materiales
- Erlenmeyer de 200 mL
- Vaso de precipitados de 100 mL
- Pipeta graduada de 50 mL
- Propipeta o pipeteador
- Tapón con tubo de vidrio
- Tubo de goma
- Espátula
- Tubo de ensayo
Reactivos
- Cloruro de sodio, cristalino
- Ácido sulfúrico sol. 95 %
- Naranja de metilo sol. 0,02 %
- Carbonato de calcio en polvo
Procedimiento – Síntesis de ácido clorhídrico
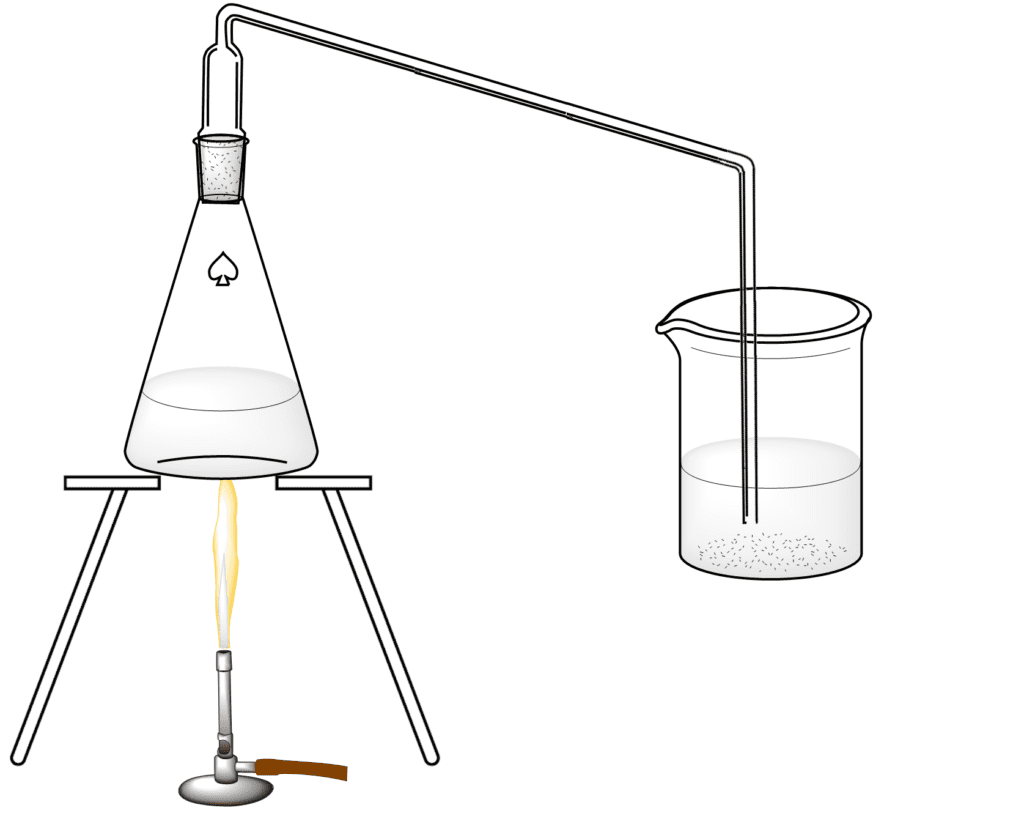
Este es uno de los métodos clásicos de preparación de ácido clorhídrico en el laboratorio por reacción del ácido sulfúrico con el cloruro de sodio, según la reacción:
En un vaso de precipitados de 100 mL, vierte agua destilada y unas gotas de solución de naranja de metilo; el color, dada su neutralidad, es amarillo-naranja.
En un matraz Erlenmeyer de 200 mL, colocar 6 g. de cloruro sódico sobre el que gotearán, con ayuda de una pipeta, 5 mL de ácido sulfúrico al 95 %, cerrando rápidamente el matraz con un tapón provisto de un tubo de desarrollo.
Inmediatamente se produce una reacción con fuerte desarrollo de un gas que, al burbujear en el agua del vaso de precipitados, convierte el naranja de metilo en rojo, revelando así que se trata de un ácido, el ácido clorhídrico (HCl).
Si se desea, es posible, utilizando una mayor cantidad de reactivos, preparar una solución más concentrada de ácido clorhídrico, que, como es sabido, es muy soluble en agua. Esta solución puede probarse no sólo por su pH, sino también por su capacidad de reaccionar rápidamente con un carbonato, por ejemplo, con el carbonato de calcio, liberando dióxido de carbono.
Tomar 5/10 mL de la solución, preparada por burbujeo, de ácido clorhídrico y verterla en un tubo de ensayo; añadirle una punta de espátula de carbonato de calcio en polvo fino. Se nota enseguida el desarrollo del dióxido de carbono, según la reacción:
Después del laboratorio
Con base a la reacción propuesta hacer los cálculos estequiométricos para obtener un litro de una solución 1 M de acido clorhídrico. ¿qué volumen ocuparía el ácido clorhídrico producido si no se almacenara como una solución?
¿Por qué el ácido clorhídrico se prefiere manejar como solución y no como gas?
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Hydrochloric Acid, Its Preparation and Properties
Como citar este artículo:
APA: (2021-08-18). Síntesis de ácido clorhídrico. Recuperado de https://quimicafacil.net/manual-de-laboratorio/sintesis-de-acido-clorhidrico/
ACS: . Síntesis de ácido clorhídrico. https://quimicafacil.net/manual-de-laboratorio/sintesis-de-acido-clorhidrico/. Fecha de consulta 2024-07-27.
IEEE: , "Síntesis de ácido clorhídrico," https://quimicafacil.net/manual-de-laboratorio/sintesis-de-acido-clorhidrico/, fecha de consulta 2024-07-27.
Vancouver: . Síntesis de ácido clorhídrico. [Internet]. 2021-08-18 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/sintesis-de-acido-clorhidrico/.
MLA: . "Síntesis de ácido clorhídrico." https://quimicafacil.net/manual-de-laboratorio/sintesis-de-acido-clorhidrico/. 2021-08-18. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net