Actualizado en enero 21, 2024
Tiempo de lectura estimado: 7 minutos
El hidrógeno es el elemento químico de símbolo H y número atómico 1. Con un peso atómico estándar de 1,008, el hidrógeno es el elemento más ligero de la tabla periódica. El hidrógeno es la sustancia química más abundante en el universo, constituyendo aproximadamente el 75% de toda la masa bariónica. Las estrellas no remanentes están compuestas principalmente por hidrógeno en estado de plasma. El isótopo más común del hidrógeno, denominado protio (nombre raramente utilizado, símbolo 1H), tiene un protón y ningún neutrón.
Preparación de hidrogeno
El gas hidrógeno se produjo por primera vez de forma artificial a principios del siglo XVI mediante la reacción de los ácidos sobre los metales. En 1766-81, Henry Cavendish fue el primero en reconocer que el hidrógeno gaseoso era una sustancia discreta, y que produce agua cuando se quema, propiedad por la que recibió posteriormente su nombre: en griego, hidrógeno significa «formador de agua».
La producción industrial se realiza principalmente a partir del reformado de vapor del gas natural y, con menor frecuencia, de métodos más intensivos en energía como la electrólisis del agua. La mayor parte del hidrógeno se utiliza cerca del lugar de su producción, siendo los dos usos más importantes el procesamiento de combustibles fósiles (por ejemplo, el hidrocraqueo) y la producción de amoníaco, principalmente para el mercado de fertilizantes. El hidrógeno es problemático en la metalurgia porque puede fragilizar muchos metales, lo que complica el diseño de las tuberías y los depósitos de almacenamiento.
Materiales
- Aparato de Kipp
- Tubo de Thistle
- Probeta de 500 mL
- Balón de fondo redondo de 250 mL
- Recipiente profundo de plástico
- Tubo de vidrio doblado o tubo de goma
Reactivos
- Gránulos o barras de zinc
- Sol de ácido clorhídrico 37 %
- Polvo de aluminio
- Sln de hidróxido de sodio. 4 o 8 M
Procedimiento
Obtención de hidrogeno con el aparato de Kipp
Se basa en la simple reacción entre el zinc y el ácido clorhídrico:
En forma iónica
El aparato de Kipp (ver dibujo) está formado por una cubeta superior que termina en un tubo que se extiende hasta la cubeta inferior. La conexión entre las dos cubetas está alineada y en el cuello de botella suele haber un disco cerámico perforado, que impide que el metal caiga en la parte inferior del aparato.
La cubeta inferior tiene un orificio con un tapón esmerilado para vaciar el ácido consumido y un orificio al que se conecta un grifo, montado sobre un tapón de goma, para la salida del gas. La botella superior está cerrada por una válvula de seguridad.
Se vierte HCl concentrado en una solución 1:1 en la botella inferior hasta que el nivel supere la barrera.
Se dejan caer gránulos de zinc o pequeños cilindros por el orificio lateral, retirando temporalmente la válvula de flujo de gas, y se vuelve a colocar la válvula cerrada.
Al entrar en contacto con el ácido, se produce hidrógeno y el gas empuja la solución hacia la cubeta inferior, haciendo que suba en el tubo central. Como resultado, el desarrollo del gas cesa rápidamente.
Para extraer el hidrógeno, basta con abrir el grifo de salida y recogerlo en un recipiente adecuado. Con esta operación, al disminuir la presión interna, la reacción vuelve a empezar y se forma más hidrógeno.
Con extrema precaución, se puede utilizar una pequeña cantidad de hidrógeno para su reconocimiento, prendiéndole fuego con una cerilla o fuente de llama.
Evidentemente, no es aconsejable intentar encender directamente el gas que sale de la llave de salida.
Montaje alternativo al aparato de Kipp
El desarrollo del aparato de Kipp facilitó la producción de distintos gases en el laboratorio para su estudio. Sin embargo, puede no estar disponible en todos los laboratorios modernos ya que actualmente muchos gases están disponibles en botellas comprimidas.
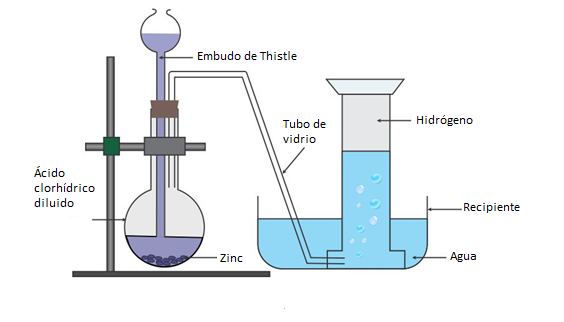
Si no se dispone de un aparato de Kipp es posible hacer un montaje como el mostrado a continuación donde el acido diluido se adiciona empleando un tubo o embudo de Thistle. El hidrógeno generado es recolectado en una probeta invertida llena de agua.
Preparación de hidrógeno a partir de aluminio en medio ácido y básico
Tomar 2 tubos de ensayo y en cada uno vierte una punta de espátula de polvo de aluminio. En uno de los tubos de ensayo, vierte 2 mL de sol de ácido clorhídrico. 37 %, agitando para favorecer la reacción. En definitiva, se observa un desarrollo de gas que puede reconocerse como hidrógeno por combustión, acercando, con precaución, una cerilla a la boca del tubo de ensayo. La reacción que se produce es:
En el segundo tubo de ensayo vierte 2 mL de sol de hidróxido de sodio. 4 u 8 M y, con la ayuda de unas pinzas, llevar la misma al bunsen para iniciar la reacción. La reacción es muy exotérmica y, una vez iniciada, procede rápidamente dando un fuerte desarrollo de gas. Esto puede ser reconocido como hidrógeno de la manera ya descrita. La reacción es:
Nota: Hay que recordar que el AlCl3 es un compuesto en el que el porcentaje de enlace covalente es tan alto que la propia sal fundida no conduce la electricidad.
En solución acuosa, debido a la alta energía de hidratación del ion Al3+, se produce la ionización de la molécula de AlCl3 con la formación de iones Al3+ hidratados e iones Cl–.
Si se cristaliza la solución, ya no se obtiene AlCl3, sino una sal formada por iones de aluminio hidratados e iones de cloro: Al(H2O)63+(Cl–)3 .
El ion Al(H2O)63+ es tan estable que, cuando la sal se calienta, se descompone, pero no elimina las moléculas de H2O.
Este comportamiento del AlCl3 es general para todas las sales de aluminio: son covalentes si son anhidras e iónicas si están hidratadas.
Después del laboratorio
Hacer los cálculos estequiométricos según cada uno de los métodos de preparación de hidrogeno presentados para obtener 1 litro de gas hidrogeno en condiciones normales.
¿Los métodos presentados son económicamente factibles para la obtención de hidrogeno a escala industrial?
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información preparation of hydrogen in the laboratory
Como citar este artículo:
APA: (2021-07-21). Preparación de hidrogeno. Recuperado de https://quimicafacil.net/manual-de-laboratorio/preparacion-de-hidrogeno/
ACS: . Preparación de hidrogeno. https://quimicafacil.net/manual-de-laboratorio/preparacion-de-hidrogeno/. Fecha de consulta 2024-07-27.
IEEE: , "Preparación de hidrogeno," https://quimicafacil.net/manual-de-laboratorio/preparacion-de-hidrogeno/, fecha de consulta 2024-07-27.
Vancouver: . Preparación de hidrogeno. [Internet]. 2021-07-21 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/preparacion-de-hidrogeno/.
MLA: . "Preparación de hidrogeno." https://quimicafacil.net/manual-de-laboratorio/preparacion-de-hidrogeno/. 2021-07-21. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net