Actualizado en enero 12, 2024
Tiempo de lectura estimado: 14 minutos
Chemistry: A Volatile History es una serie documental de la BBC de 2010 sobre la historia de la química presentado por Jim Al-Khalili. Fue nominada para los Premios de Televisión de la Academia Británica 2010 en la categoría Specialist Factual.
- Episodio 2: El orden de los elementos
- Los átomos de John Dalton
- La búsqueda de pesos atómicos de Jöns Jacob Berzelius
- Tríadas de Johann Döbereiner
- Dmitri Mendeleev se traslada a San Petersburgo
- Estándar de Stanislao Cannizzaro para la medición de pesos atómicos
- Las octavas de John Newlands
- La tabla periódica de Mendeleev
- El quemador de Bunsen y el espectrómetro de Kirchhoff
- Paul Emile Lecoq de Boisbaudran descubre el galio
- Pierre Janssen y Norman Lockyer descubren el helio
- William Ramsay descubre los gases nobles
- Mendeleev reivindicado
- El modelo de orbita fija de Niels Bohr
- Los números de protones de Henry Moseley
Episodio 2: El orden de los elementos
A principios del siglo XIX sólo se habían descubierto 55 de los 92 elementos naturales. Los científicos no tenían idea de cuántos más podrían encontrar, o incluso si había un número infinito de elementos. También trataron de responder a una pregunta fundamental, a saber: ¿existe un patrón en los elementos?
Los átomos de John Dalton
Los científicos han descubierto recientemente que cuando los elementos se combinan para formar compuestos, siempre lo hacen en las mismas proporciones, por peso. John Dalton pensó que para que esto sucediera, cada elemento tenía que estar hecho de sus propios y únicos bloques de construcción, a los que él llamaba átomos.

Dalton sugirió que todo en el universo estaba hecho de átomos, y que hay tantos tipos de átomos como elementos, cada uno con su propio peso de firma. Basándose en estas ideas, trabajando completamente solo, Dalton intentó imponer un cierto orden a los elementos mediante la elaboración de una lista, en la que cada elemento estaba representado por un símbolo de aspecto alquímico, ordenado por peso atómico.
Aunque Dalton no logró corregir todos sus pesos atómicos, estaba apuntando a la ciencia en la dirección correcta. Lamentablemente, a principios del siglo XIX pocos científicos aceptaron la idea de que los elementos tenían diferentes pesos.
La búsqueda de pesos atómicos de Jöns Jacob Berzelius
El científico sueco Jöns Jacob Berzelius fue uno de los pocos científicos que creyó firmemente en la idea de los pesos atómicos, y pensó que era de vital importancia saber lo más posible sobre sus pesos.
Cuando oyó hablar de la teoría de Dalton, se dedicó a la gigantesca tarea de medir el peso atómico de cada uno de los elementos conocidos, sin ninguna prueba de que los átomos de Dalton existieran realmente.
Esto fue aún más desafiante de lo que parece al principio, una vez que se considera el hecho de que se había inventado muy poco de la cristalería química necesaria para estas mediciones tan precisas. Berzelius tuvo que fabricar gran parte de ella él mismo.
Las experiencias de Berzelius con el soplado de vidrio tuvieron un plus adicional: en 1824 descubrió que uno de los componentes del vidrio era un nuevo elemento: el silicio.
Habiendo descubierto ya otros tres elementos antes del silicio: torio, cerio y selenio, Berzelius pasó los siguientes diez años midiendo obsesivamente más de dos mil compuestos químicos en busca de pesos atómicos precisos para los elementos.
Eventualmente Berzelius tenía pesos atómicos notablemente precisos para 45 elementos; su valor de cloro era exacto dentro del 0.2% del valor que conocemos hoy en día.
Sin embargo, para cuando Berzelius produjo sus resultados, otros científicos ya estaban midiendo pesos atómicos – y obteniendo resultados contradictorios. De hecho, los científicos estaban buscando todo tipo de patrones a través de los elementos.
Tríadas de Johann Döbereiner
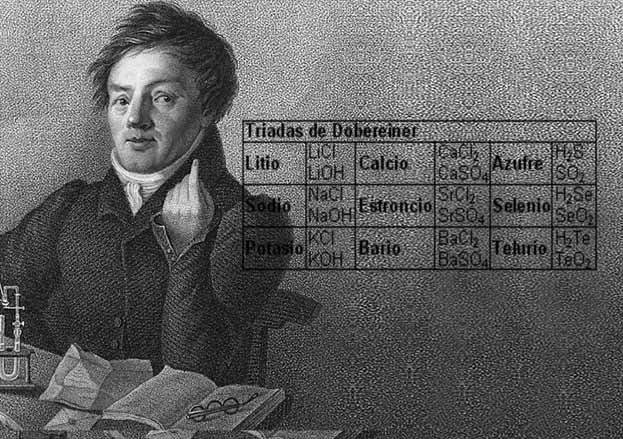
Uno de estos cazadores de patrones era el químico alemán Johann Döbereiner. Él creía que la clave para entender los elementos no radicaba en su peso atómico, sino en sus propiedades químicas. Se dio cuenta de que a menudo se podían distinguir tres elementos que exhibían propiedades similares, como los metales alcalinos, a los que llamaba tríadas.
El problema era que las tríadas de Döbereiner sólo funcionaban para algunos de los elementos y no permitían a los científicos ir más allá de los pesos atómicos.
Dmitri Mendeleev se traslada a San Petersburgo
En 1848 un gran incendio destruyó la fábrica de la viuda María Mendeleeva. Enfrentada a la miseria, decidió embarcarse en el viaje de 1.300 millas desde Siberia Occidental a San Petersburgo – caminando una parte significativa de la ruta – para que su hijo Dmitri Mendeleev pudiera continuar su educación en la capital del Imperio Ruso.
En ese momento, la comunidad científica estaba lidiando con el problema de cómo poner orden en los 63 elementos que ahora se conocían. Mendeleev todavía era estudiante cuando asistió al primer congreso internacional de química del mundo, convocado para resolver la confusión que rodea a los pesos atómicos.
Estándar de Stanislao Cannizzaro para la medición de pesos atómicos
El químico siciliano Stanislao Cannizzaro seguía convencido de que los pesos atómicos eran la clave del orden de los elementos y había encontrado una nueva forma de medirlos. Cannizzaro sabía que los mismos volúmenes de gases contienen el mismo número de partículas, por lo que en lugar de trabajar con sólidos y líquidos y toda la falta de fiabilidad que ello implica, propuso medir las densidades de los gases para medir el peso de los átomos gaseosos individuales.
Mientras que los resultados de Berzelius no convencieron a nadie, el método de Cannizzaro estableció un estándar acordado para medir los pesos atómicos con precisión. Los químicos pronto descubrieron que incluso con pesos atómicos precisos, los elementos aún parecían desordenados, pero entonces, un químico inglés solitario hizo un curioso descubrimiento.
Las octavas de John Newlands
En 1863 John Newlands notó que cuando se ordenaba por peso, cada octavo elemento parecía compartir propiedades similares, como el carbono y el silicio en la secuencia: carbono, nitrógeno, oxígeno, flúor, sodio, magnesio y silicio. Él llamó a esto una Ley de Octavas.
Tres años más tarde, en 1866, presentó sus ideas a la Sociedad Química, desafortunadamente para Newlands, la analogía musical no fue bien recibida – la audiencia sugirió que también podría haber ordenado los elementos alfabéticamente.
Hoy en día, los Octavos de Newlands son conocidos como la Ley de la Periodicidad, y Mendeleev estaba pensando en la misma línea.
La tabla periódica de Mendeleev
Para 1869 Mendeleev había estado tratando de encontrar un orden para los elementos durante una década. Un día se le ocurrió la idea de hacer una baraja con los nombres de los elementos y empezó a jugar a un juego que llamó «solitario químico». Comenzó a colocar las cartas, una y otra vez, sólo para ver si podía formar un patrón en el que todo encajara a la perfección.

Hasta la fecha, los químicos habían intentado agrupar los elementos de una de dos maneras:
Por sus pesos atómicos (Berzelius’ y Cannizzaro’s Atomic Weights);
Por sus propiedades químicas (Tríadas de Döbereiner y Octavas de Newland).
El genio de Mendeleev fue combinar esos dos métodos. Sin embargo, las probabilidades estaban en su contra – poco más de la mitad de los elementos conocidos habían sido descubiertos: estaba jugando con una baraja de cartas incompleta.
Permaneció despierto durante tres días y tres noches y, finalmente, el 17 de febrero de 1869, se durmió y soñó con los 63 elementos conocidos dispuestos en una gran mesa.
La tabla de Mendeleev revela la relación entre todos los elementos de su orden:
Los pesos atómicos aumentan la lectura de izquierda a derecha;
Tríadas y Octavas son visibles leyendo en las columnas.
Note que el carbono y el silicio están en el Grupo IV y los gases volátiles flúor, cloro y bromo están en el Grupo VII.
Mendeleev tenía suficiente confianza en el diseño de su mesa que estaba dispuesto a dejar huecos para elementos desconocidos para hacer encajar el patrón – creyendo que más tarde se descubrirían otros elementos que llenaran los huecos.
Después del calcio (Ca, peso 40) dejó un hueco, prediciendo un elemento metálico ligeramente más pesado que el calcio;
Después del Zinc (Zn, peso 65) dejó un hueco, prediciendo un metal con un bajo punto de fusión y un peso atómico de 68;
Inmediatamente después de ese hueco, dejó otro hueco, prediciendo otro metal, de color gris oscuro.
Así que, para que Mendeleev se reivindicara, había que llenar los huecos y, afortunadamente, en 1859, se había desarrollado una nueva instrumentación para descubrir los elementos.
El quemador de Bunsen y el espectrómetro de Kirchhoff
Robert Bunsen sabía que cuando ciertos elementos ardían en las llamas de su quemador, cada uno de ellos convertía la llama en un color diferente. Cobre quemado verde, rojo estroncio y lila potásica – Bunsen se preguntó si cada elemento tenía un color único.
A Bunsen se le unió en su investigación Gustav Kirchhoff. Kirchhoff utilizó el concepto de la dispersión de la luz blanca por medio de un prisma en la invención del espectroscopio, un dispositivo con un prisma en el centro que separaba la luz de las llamas de Bunsen en bandas distintas de sus colores constituyentes: las líneas espectrales del elemento.
Kirchhoff y Bunsen se dieron cuenta de que estas líneas espectrales eran únicas para cada elemento y, utilizando esta técnica, descubrieron dos nuevos elementos, el cesio y el rubidio.
Paul Emile Lecoq de Boisbaudran descubre el galio
En 1875, el químico parisino Paul Emile Lecoq de Boisbaudran utilizó un espectroscopio para descubrir un nuevo elemento metálico. Era un metal blando de color blanco plateado con un peso atómico de 68, al que bautizó con el nombre de galio, en honor a su Francia natal.
También resultó tener un punto de fusión muy bajo, por lo que se ajustaba a todas las propiedades esperadas del elemento que Mendeleev esperaba que ocupara el hueco que había dejado después del zinc; de hecho, aquí es exactamente donde se colocó el elemento en la tabla periódica.
Aunque Mendeleev había dejado el hueco necesario para el galio y otros elementos, era evidente que faltaba todo un grupo.
Pierre Janssen y Norman Lockyer descubren el helio
En 1868, el astrónomo francés Pierre Janssen viajó a la India a tiempo para el eclipse total de sol que ocurrió en agosto de ese año. Además de su telescopio, también fue equipado con un espectroscopio, para estudiar las líneas espectrales de la luz emitida por el sol.
Normalmente, debido a la intensidad de la luz solar, muchas líneas espectrales más débiles no son visibles junto al brillo extremo de las líneas más fuertes. Janssen esperaba observar más líneas espectrales durante el eclipse cuando la luz del sol era menos intensa.
El eclipse permitió a Janssen observar una línea espectral nunca antes vista, que no estaba asociada a ningún elemento conocido. La misma línea espectral fue confirmada por el astrónomo inglés Norman Lockyer, quien pensando que el elemento sólo existía en el sol, le dio el nombre de helio, en honor al dios griego del sol.
Sin embargo, no pasó mucho tiempo antes de que otro científico británico descubriera el helio en la Tierra.
William Ramsay descubre los gases nobles
Al disolver el mineral radioactivo cleveita en ácido, William Ramsay pudo recoger un gas atrapado en la roca, que tenía un peso atómico de 4, y las mismas líneas espectrales que Lockyer había observado: el helio. Antes de esto, Ramsay ya había aislado un nuevo gas de la atmósfera, el argón, con un peso atómico de 40.

Surgió un problema: Mendeleev no había dejado ningún hueco adecuado para ninguno de estos dos nuevos elementos, lo que llevó a Ramsay a la conclusión de que faltaba todo un grupo en la tabla periódica; sólo dos de cuyos miembros se sabía que existían en la actualidad, el helio y el argón.
Ramsey descubrió con éxito todos los otros elementos estables del grupo, a los que denominó neón (griego para nuevo), criptón (griego para oculto) y xenón (griego para desconocido).
Todos los elementos de este nuevo grupo tenían una característica abrumadora: su falta de reactividad. Fue esta característica particular la que me hizo pensar en un nombre para el nuevo grupo: los gases nobles.
Mendeleev reivindicado
La tabla periódica de Mendeleev había puesto orden en todos los elementos, permitiéndole hacer predicciones que los futuros científicos probaron y encontraron ciertas. Para cuando murió era mundialmente famoso en química. Su tabla periódica fue grabada en piedra en San Petersburgo y finalmente un elemento fue nombrado en su honor: mendelevium.
Sin embargo, la tabla periódica no nos dice por qué algunos elementos son altamente reactivos, otros completamente inertes, algunos volátiles, mientras que otros no tanto. No fue hasta principios del siglo XX que una rama completamente diferente de la ciencia comenzó a desentrañar las respuestas a estas preguntas.
El modelo de orbita fija de Niels Bohr
En 1909, el físico Ernest Rutherford propuso que la estructura del átomo era como la de un sistema solar: en su mayoría espacio vacío con electrones flotando alrededor de un núcleo denso.
Posteriormente, el físico danés Niels Bohr introdujo la idea de que los electrones ocupaban «capas fijas» alrededor del núcleo, que se desarrolló más cuando se sugirió que cada una de estas capas sólo podía alojar un número fijo de electrones: 2 en la primera capa; 8 en la segunda capa; 18 en la tercera capa, y así sucesivamente, cada capa conteniendo un número creciente de electrones.

El comportamiento químico de todos los elementos se explica por el número de electrones en sus capas exteriores: para aumentar la estabilidad energética de sus configuraciones electrónicas, los átomos tienen una tendencia a ganar o perder electrones de tal manera que consiguen una capa exterior completa.
El sodio, con 11 electrones -uno en su capa más externa ocupada-, transferirá un electrón en presencia de flúor a su capa más externa ocupada, que contiene siete electrones. El resultado es que tanto el sodio como el flúor tienen ahora una cubierta exterior completa y se forma fluoruro de sodio.
Esta teoría explica por qué todos los elementos reaccionan de la manera en que lo hacen y por qué algunos formaron los compuestos que hacen, mientras que otros no.
También explicaba por qué los elementos tenían las propiedades físicas que tenían, lo que a su vez explicaba por qué la tabla periódica tenía la forma que tenía. Sin embargo, había una pregunta fundamental que quedaba sin respuesta: ¿Cuántos elementos existían?
Los números de protones de Henry Moseley
A principios del siglo XX, el químico Henry Moseley especuló que la respuesta al número de protones estaba en el núcleo. Al disparar una fuente radioactiva al cobre, fue capaz de golpear a los electrones de sus átomos, liberando una ráfaga de energía en forma de rayos X.

Cuando se miden, los rayos X siempre tienen la misma energía, exclusiva del cobre. Descubrió que cada elemento liberaba rayos X de diferentes energías. La brillantez de Moseley fue darse cuenta de que la energía de los rayos X está relacionada con el número de protones dentro del átomo: el número atómico.
Debido a que este es el número de protones, el número atómico debe ser un número entero – no puede haber ningún valor fraccionario. Moseley se dio cuenta de que era el número atómico, no el peso atómico el que determinaba el orden de los elementos.
Es más, porque el número atómico aumenta en números enteros de un elemento al siguiente no puede haber elementos adicionales entre el Hidrógeno (número atómico 1) y el Uranio (número atómico 92) – sólo puede haber 92 elementos, no hay lugar para más.
Moseley tenía sólo 26 años cuando completó esta investigación. A los 27 años fue asesinado en combate durante la Primera Guerra Mundial, con un disparo en la cabeza por un francotirador.
Mira el Primer capitulo de Chemistry: A Volatile History aqui
Mira el tercer episodio de Chemistry: A Volatile History aqui
Quimicafacil.net no ostenta ningún tipo de derecho sobre este material audiovisual y solo se limita a su recomendación para el interés del publico general.
Como citar este artículo:
APA: (2019-10-26). Chemistry: A Volatile History Episodio 2. Recuperado de https://quimicafacil.net/documentales/chemistry-a-volatile-history-episodio-2/
ACS: . Chemistry: A Volatile History Episodio 2. https://quimicafacil.net/documentales/chemistry-a-volatile-history-episodio-2/. Fecha de consulta 2024-07-27.
IEEE: , "Chemistry: A Volatile History Episodio 2," https://quimicafacil.net/documentales/chemistry-a-volatile-history-episodio-2/, fecha de consulta 2024-07-27.
Vancouver: . Chemistry: A Volatile History Episodio 2. [Internet]. 2019-10-26 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/documentales/chemistry-a-volatile-history-episodio-2/.
MLA: . "Chemistry: A Volatile History Episodio 2." https://quimicafacil.net/documentales/chemistry-a-volatile-history-episodio-2/. 2019-10-26. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net
