Actualizado en febrero 15, 2022
Tiempo de lectura estimado: 8 minutos
La destilación simple constituye el método más frecuente e importante para la purificación de líquidos. Se utiliza siempre en la separación de un líquido de sus impurezas no volátiles y, cuando ello es posible, en la separación de dos o más líquidos.
Cuando un líquido puro se introduce en un recipiente cerrado y vacío parte de este se evapora hasta que el vapor alcanza una determinada presión, que depende solamente de la temperatura.
Esta presión, que es la ejercida por el vapor en equilibrio con el líquido, es la presión de vapor del líquido a esa temperatura. Cuando la temperatura aumenta, la presión de vapor también aumenta regularmente hasta que llega un momento en que la presión de vapor alcanza el valor de 760 mm, entonces, si el líquido está en contacto en el exterior, comienza a ebullir. La temperatura a la que esto ocurre recibe el nombre de punto de ebullición normal del líquido en cuestión, y es una constante característica para cada líquido.
Ebullición de mezclas
Cuando se calienta una solución o una mezcla de dos o más líquidos, el punto de ebullición normal es entonces la temperatura a la cual la presión de vapor total de la mezcla es igual a la presión atmosférica (760 mm). La presión de vapor total de una mezcla es igual a la suma de las presiones de vapor parciales de cada componente.
En las soluciones ideales, las únicas que vamos a considerar, se cumple la ley de Raoult, que se expresa en los siguientes términos: «La presión parcial de un componente en una disolución a una temperatura dada es igual a la tensión de vapor de la sustancia pura multiplicado por su fracción molar en la solución».

De la ley de Raoult se puede deducir las siguientes conclusiones:
- El punto de ebullición de una mezcla depende de los puntos de ebullición de sus componentes y de sus proporciones relativas
- En una mezcla cualquiera de dos líquidos, el punto de ebullición está comprendido entre los puntos de ebullición de los componentes puros
- El vapor producido será siempre más rico en el componente de punto de ebullición más bajo.
Siempre que se tenga una mezcla de dos o más componentes que se diferencien suficientemente en sus puntos de ebullición, se podrá separar en sus componentes por destilación. Se pueden distinguir tres tipos principales de destilación: destilación simple sencilla, destilación fraccionada y destilación a vacío.
Destilación simple
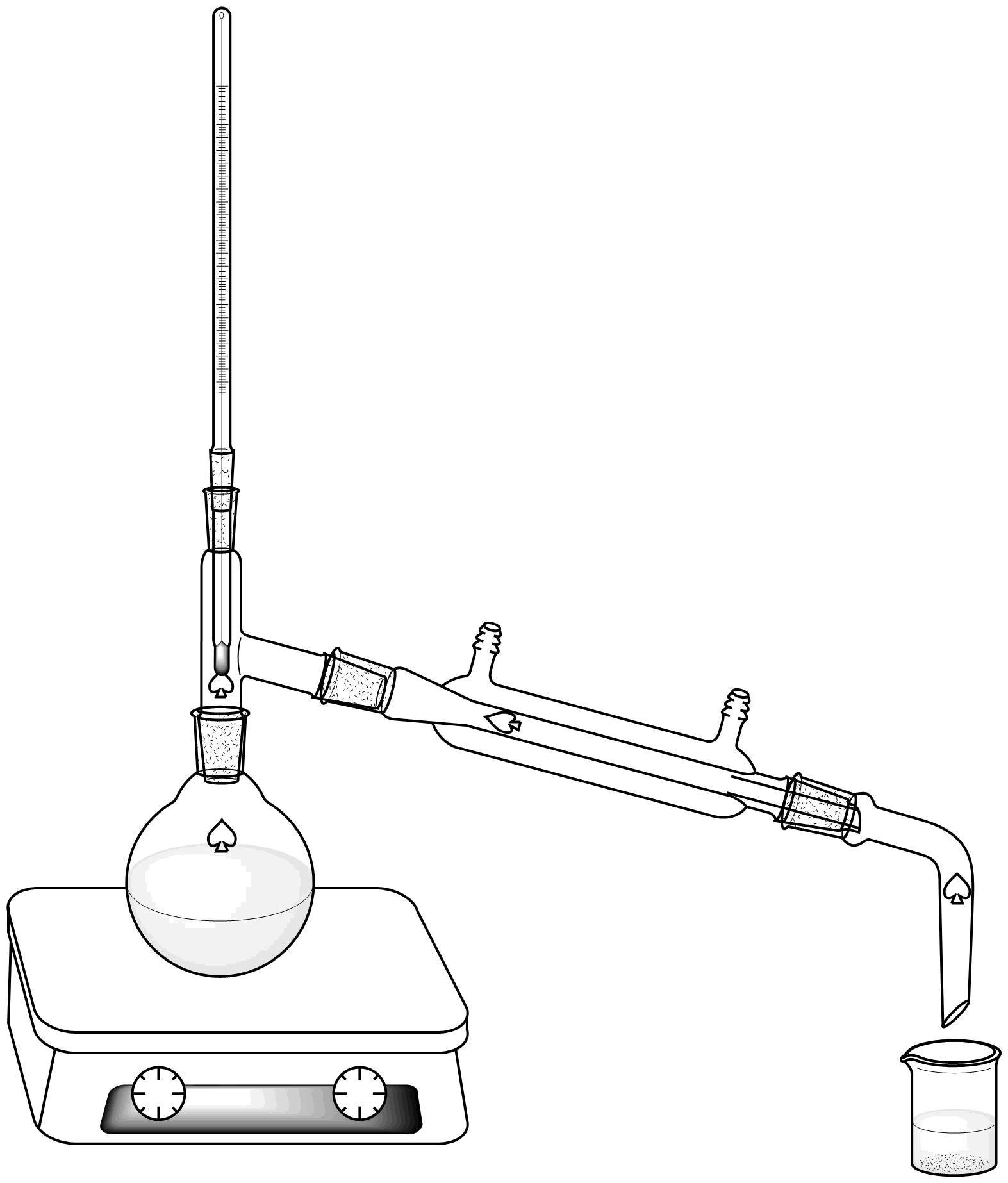
Para la destilación simple se utiliza un montaje como el representado en la figura de la sección procedimiento con la ayuda de dos soportes universales . Consta de un matraz o balón de destilación, provisto de un adaptador para termómetro. El matraz descansa sobre una placa calefactora.
El balón de destilación va unido a un condensador por la que circula agua en contracorriente. Finalmente, el extremo inferior del refrigerante se une a una alargadera que conduce el destilado al balón de recolección.
El líquido o mezcla que se quiere destilar se pone en el matraz (que no debe llenarse mucho más de la mitad de su capacidad) y se calienta con la placa calefactora. Cuando se alcanza la temperatura de ebullición del líquido comienza la producción apreciable de vapor, condensándose parte de este en el termómetro y en las paredes del matraz.
La mayor parte del vapor pasa a través del brazo lateral de la cabeza de destilación al refrigerante donde se condensa debido a la corriente de agua fría que asciende la pared de este. El destilado (vapor condensado) escurre al balón recolector a través de la alargadera.

Durante la destilación el extremo superior del bulbo del termómetro debe quedar justamente a la altura de la horizontal que pasa por la parte inferior de la cabeza de destilación o del brazo lateral del accesorio o balón, de tal forma que todo el bulbo sea bañado por el vapor que asciende.
La destilación debe hacerse con lentitud, pero sin interrupciones, manteniendo para ello el calentamiento adecuado. Casi todos los líquidos tienden a sobrecalentarse (alcanzar una temperatura algo superior al punto de ebullición). Se encuentran entonces en un estado metaestable que se interrumpe periódicamente al formarse súbitamente una gran burbuja de vapor en el seno del líquido.
Cuando se observa este fenómeno, se dice entonces que este hierve a saltos. Para evitar esto, antes de iniciar la destilaciónse añaden al líquido uno o dos trocitos de porcelana porosa o piedras de ebullición, cuyos pequeños poros constituyen un lugar adecuado para la formación de núcleos de burbujas, hirviendo así el líquido normalmente al alcanzarse la temperatura de ebullición.
Si el líquido permanece a cierto tiempo a una temperatura inferior a su punto de ebullición, entonces los poros de la porcelana se llenan de líquido y ésta pierde su efectividad. Para la adición de un nuevo trocito, el líquido debe enfriarse por debajo de su punto de ebullición; la adición de un trocito de material poroso a un líquido sobrecalentado provoca una ebullición repentina que puede ser violenta lo que puede acarrear peligro de incendio y quemaduras.
La existencia de una capa de sólido en el fondo del matraz de destilación puede ser causa de violentos saltos durante la destilación, especialmente si se utiliza una calefacción local fuerte en el fondo del matraz. La calefacción de un matraz que lleva cierta cantidad de sólido depositado en el fondo se debe realizar siempre mediante un baño líquido.
Mediante la destilación sencilla que se acaba de describir se pueden separar mezclas de dos componentes que hiervan con una diferencia de puntos de ebullición de al menos 60 -80°C.
Mezclas de sustancias cuyos puntos de ebullición difieren de 30-60°C se pueden separar por destilaciones sencillas repetidas, recogiendo durante la primera destilación fracciones enriquecidas en uno de los componentes, las cuales se vuelven a destilar.
Materiales
- Balón de fondo plano de 100 mL
- Probeta graduada de 100 mL
- 3 Erlenmeyer de 50 mL
- Condensador recto
- Cabeza de destilación con adaptador para termómetro
- Termómetro de laboratorio
- Alargadera de vidrio
- Plancha de calentamiento
- Piedras o perlas de ebullición
- Soporte universal
- Pinza para condensador
- Pinzas para sujeción
- Soporte universal
Reactivos
- Acetona
- Agua destilada
Procedimiento – Fraccionamiento por repetición de destilaciones simples
Tiempo necesario: 50 minutos
Realizar el montaje de destilación simple según se indica en la figura, utilizando un matraz o balón de fondo redondo de 100 mL.

Ponga en el matraz 30 mL de acetona, 30 mL de agua y dos o tres trocitos de piedras de ebullición.
Haga circular una corriente suave de agua del grifo por el refrigerante, uniendo la entrada de este al grifo con una manguera de goma. El agua que sale del refrigerante por su parte superior se conducirá a un desagüe mediante otra manguera.
AnuncioEtiquete y numere tres matraces erlenmeyer pequeños para recoger las siguientes fracciones:
I 56-65 °C
II 65-95 °C
III Residuo del balón de destilaciónCaliente el balón de forma que el destilado se recoja de una manera continua a una velocidad aproximada de una gota por segundo. Cambie los Erlenmeyers colectores con rapidez a los intervalos de temperatura indicados. Cuando la temperatura alcance 95 °C interrumpa la destilación y deje enfriar el matraz o balón de destilación.
Mida con una probeta graduada los volúmenes de destilado obtenido en cada fracción, así como el del residuo del matraz. Anote los volúmenes obtenidos. La fracción I está formada principalmente por acetona y el residuo por agua. La fracción II es una mezcla de acetona y agua.
AnuncioDeje que el matraz de destilación vacío se enfríe y ponga en él el contenido del Erlenmeyer II y vuelva a montar el aparato de destilación.
Añada dos o tres piedras de ebullición nuevas y destile de nuevo, añadiendo la fracción que destile entre 56-65 °C al Erlenmeyer I y recogiendo de nuevo en el matraz II la que destile a 65-95 °C. Cuando se alcance los 95°C detener el calentamiento y dejar enfriar el balón.
Una vez que el balón de destilación se haya enfriado un poco, vierta el residuo que quede en él en el Erlenmeyer III. Mida de nuevo y anote el volumen total de cada fracción. Apunte todos los valores obtenidos en cada etapa.
Después del experimento
Con base a los valores iniciales de acetona y agua destilada agregados en la primera destilación, calcule la eficiencia de la destilación con base a los volúmenes recuperados de cada fracción tanto en la primera destilación como en la segunda.
Cualitativamente, ¿qué influencia ejercerán cada una de las siguientes impurezas en el punto de ebullición de la acetona?: a) alcohol etílico (78,8 °C), b) éter etílico (35 °C), c) azúcar.
Enuncie dos razones que justifiquen que el agua fría circule en un refrigerante en sentido ascendente por la chaqueta del condensador
¿Se podría separar por destilación simple una mezcla de dos líquidos de puntos de ebullición 77 °C y 111 °C? ¿Y por destilación sencilla? ¿Qué líquido se recogería en primer lugar?
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Más información Distillation – Wired Chemist
Como citar este artículo:
APA: (2020-03-18). Tecnicas basicas de separacion II – destilacion simple. Recuperado de https://quimicafacil.net/manual-de-laboratorio/tecnicas-basicas-de-separacion-ii-destilacion-simple/
ACS: . Tecnicas basicas de separacion II – destilacion simple. https://quimicafacil.net/manual-de-laboratorio/tecnicas-basicas-de-separacion-ii-destilacion-simple/. Fecha de consulta 2024-07-27.
IEEE: , "Tecnicas basicas de separacion II – destilacion simple," https://quimicafacil.net/manual-de-laboratorio/tecnicas-basicas-de-separacion-ii-destilacion-simple/, fecha de consulta 2024-07-27.
Vancouver: . Tecnicas basicas de separacion II – destilacion simple. [Internet]. 2020-03-18 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/tecnicas-basicas-de-separacion-ii-destilacion-simple/.
MLA: . "Tecnicas basicas de separacion II – destilacion simple." https://quimicafacil.net/manual-de-laboratorio/tecnicas-basicas-de-separacion-ii-destilacion-simple/. 2020-03-18. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net