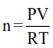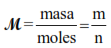Actualizado en junio 26, 2023
Tiempo de lectura estimado: 7 minutos
La masa molar de un compuesto químico se define como la masa de una muestra de ese compuesto dividida por la cantidad de sustancia en esa muestra, medida en moles. La masa molar es una propiedad masiva, no molecular, de una sustancia.
Por definicion, la masa molar es un promedio de muchas instancias del compuesto, cuya masa suele variar debido a la presencia de isótopos. Lo más habitual es que la masa molar se calcule a partir de los pesos atómicos estándar, por lo que es una función de la abundancia relativa de los isótopos de los átomos constituyentes en la Tierra.
Determinación de la masa molar de un vapor condensable empleando la ley de gases ideales
La masa molar de un vapor condensable puede determinarse añadiendo un exceso del líquido correspondiente a un bulbo pesado, calentando el conjunto para volatilizar todo el líquido y expulsar el exceso de vapor, enfriando y pesando después el bulbo con el vapor condensado. Para el estudio se utilizarán uno de los dos líquidos orgánicos, la metil etilcetona (MEK) o el acetato de etilo (EA).
En este experimento colocaremos un líquido que posee un punto de ebullición bajo en un matraz que posee una pequeña abertura. A continuación, el matraz se introduce en un vaso de precipitados con agua hirviendo (lo que a veces se denomina baño de agua o baño de Maria). El baño de agua garantiza que la temperatura del gas sea la misma que la del punto de ebullición del agua (100°C si la presión barométrica es de 1 atm). La pequeña abertura del matraz permite que el vapor del líquido salga a un ritmo controlado y garantiza que la presión del vapor en el recipiente sea igual a la presión barométrica. La ley de los gases ideales (PV = nRT) puede utilizarse entonces para determinar el número de moles de un gas que ocupa el recipiente:
donde P es la presión barométrica, V es el volumen del gas que ocupa el recipiente, R es la constante universal de los gases y T es la temperatura del gas y es la misma temperatura del agua.
Si enfriamos rápidamente el vapor, el gas se licuará y podrá pesarse. La masa de este vapor condensado es igual a la masa de vapor que llena el matraz a la temperatura elevada y presión barométrica.
La masa molar del líquido/vapor es entonces
Podemos comparar los resultados de este procedimiento con la masa molar conocida del compuesto. Un resultado dentro del 20% del valor real no es inusual.
Materiales
- Balón de fondo redondo de 250 ml
- Vaso de precipitados de 1000 ml
- Plancha de calentamiento
- Soporte universal
- Pinza para balón sin nuez
- Nuez doble
- Termómetro
Reactivos
- Metil etil cetona (mek)
- Acetato de etilo
Procedimiento
Colocar una placa de calentamiento en la parte inferior de un soporte circular. Poner un vaso de precipitados de un litro, que contenga unos 700 mL de agua del grifo, sobre la placa y utilizar el ajuste a «HI» para conseguir un calentamiento rápido.
Cuando el agua hierva, reducir el ajuste a 5 o 6 para mantener una ebullición suave hasta completar todas las mediciones de masa de este experimento. Colocar un pequeño recipiente casi lleno de agua en una de las esquinas de la placa de calentamiento, para utilizarlo posteriormente para mantener el nivel de agua en el vaso grande.
Obtener un cuadrado de papel de aluminio (de unos 5 cm de lado) y hacer una tapa para el balón de fondo redondo de 250 ml colocando el papel sobre la boca y doblando los lados. Con un alfiler, hacer un pequeño agujero (lo más pequeño posible) en el centro de la tapa.
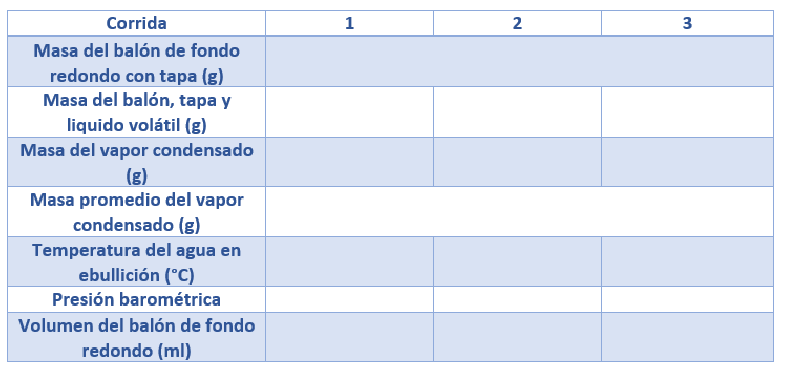
Determinar la masa del balón de fondo redondo limpio con la tapa con una precisión de 0,1 mg utilizando la balanza analítica. Obtenga de su instructor unos 3 mL de un líquido desconocido (que contenga unos miligramos de colorante para ayudarle a ver la desaparición del líquido) en el balón. Vuelva a colocar la tapa de forma delicada. No pese el balón en este momento.
Sujetar el balón desde su cuello y cerca del borde con la pinza para balón y colocarlo tan abajo en el vaso de precipitados como lo permita la abrazadera. Fije la pinza al soporte universal con la nuez doble de manera que el balón esté lo suficientemente inclinado como para concentrar su líquido en una «esquina». Registra también la presión barométrica.
Mientras el agua hierve, observa el líquido en el balón. Un minuto después de que todo el líquido parezca haberse evaporado, retira el balón y la pinza del soporte universal. Deja que el agua fría del grifo corra sobre el balón, teniendo cuidado de que no caiga agua sobre o bajo la tapa de papel de aluminio.
Utilice toallas de papel para secar el balón de fondo redondo y para limpiar el papel de aluminio en caso de que haya gotas de agua en él. Pese el balón, el tapón y el líquido desconocido condensado. Asegúrese de reajustar el nivel de agua en el vaso de precipitados a unos 700 mL durante el experimento.
Sin vaciar el líquido del matraz, añadir más líquido al balón de fondo redondo (quizás 1 mL) para tener una cantidad de líquido similar a la que se tenía antes. A continuación, proceda como lo hizo con la primera muestra. Si los dos pesos de vapor condensado difieren en más de 0,05 g, se debe obtener más líquido y repetir el procedimiento. Los dos pesos más cercanos, los que están dentro de 0,05 g de diferencia, deben utilizarse para encontrar la masa media de vapor condensado.
Deseche el líquido (MEK o EA) en el contenedor de residuos orgánicos previsto. Enjuague el balón de fondo redondo y llénelo completamente con agua del grifo. El balón de fondo redondo no tiene un volumen exacto de 250 mL, por lo que se debe determinar el volumen real. Mida el volumen del balón hasta el tope empleando una probeta graduada con una precisión de 1 mL.
Después del laboratorio
Datos y relaciones importantes para los cálculos
1 atm = 760 Torr = 760 mmHg
1 mL = 10-3 L
K = °C + 273.15
Ley de los gases ideales PV=nRT
Masa molar = masa de vapor/moles de vapor
Calcular el % de error en la medición de la masa molar del líquido de trabajo con respecto al valor reportado en la literatura.
Explicar dos o tres formas en las que las mediciones que ha realizado podrían dar lugar a errores en los resultados. Explicar cómo afectaría cada error a la respuesta de la masa molar. En otras palabras, ¿la masa molar subiría o bajaría y por qué?
Tabla de datos
Tabla de resultados
Para más información Molar Mass of a Condensable Vapor
Como citar este artículo:
APA: (2023-01-18). Masa molar de un vapor condensable. Recuperado de https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/masa-molar-de-un-vapor-condensable/
ACS: . Masa molar de un vapor condensable. https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/masa-molar-de-un-vapor-condensable/. Fecha de consulta 2024-07-27.
IEEE: , "Masa molar de un vapor condensable," https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/masa-molar-de-un-vapor-condensable/, fecha de consulta 2024-07-27.
Vancouver: . Masa molar de un vapor condensable. [Internet]. 2023-01-18 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/masa-molar-de-un-vapor-condensable/.
MLA: . "Masa molar de un vapor condensable." https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/masa-molar-de-un-vapor-condensable/. 2023-01-18. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net