Tiempo de lectura estimado: 6 minutos
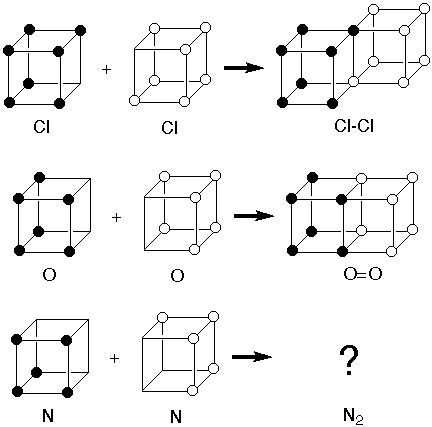
El baño de María consiste en un recipiente con agua en su interior donde se coloca un recipiente más pequeño donde se encuentra la sustancia que se necesita calentar. También puede ser un recipiente con pared doble por donde se circula agua.
Un baño de María es un método de calentamiento suave utilizado en el laboratorio para mantener una temperatura constante alrededor de un recipiente que contiene sustancias sensibles al calor. Consiste en un recipiente con agua caliente en su interior, sobre el cual se coloca un recipiente más pequeño con el material que se necesita calentar.
Alternativamente, se puede emplear un contenedor con doble pared por donde circula agua para mantener una temperatura uniforme. Este método es especialmente útil para realizar procesos de destilación y reacciones químicas que requieren un calentamiento controlado sin riesgo de choques térmicos.
El baño de María se utiliza ampliamente en el laboratorio debido a su capacidad para proporcionar un calentamiento suave y uniforme, sin la necesidad de aplicar calor directo a la muestra, lo que ayuda a prevenir la degradación o el sobrecalentamiento del material sensible.

Historia del baño de María
El control de la temperatura es uno de los parámetros fundamentales en los experimentos químicos y no siempre es sencillo. Tales preocupaciones se remontan a las nieblas del tiempo. Para el alquimista, el conjunto de propiedades manifestadas por la materia – su forma – se pensaba que estaba determinado por la interacción de la materia con los espíritus, entidades vaporosas parecidas al aliento que también eran responsables de fenómenos misteriosos como el fuego y la vida misma.
Así pues, la transmutación, a menudo descartada como un intento tonto de convertir el plomo en oro, era el proceso serio de alterar la forma de la materia por pasos juiciosos que iban en paralelo al ciclo de la vida del hombre. Un suave paso de cohobación – a veces llevado a cabo usando estiércol caliente – insuflaría vida al sistema, de la misma manera que una gallina se sienta en sus huevos.
El ennegrecimiento por calentamiento era el análogo de la putrefacción del cuerpo. La calcinación, el blanqueamiento, podría pensarse como el equivalente al blanqueamiento de los huesos. La destilación y la sublimación eran, en efecto, la resurrección del cuerpo después de la muerte, acercando tanto lo material como lo alquimista a la perfección y a la inmortalidad.
Los primeros pasos de la alquimia
El primer tratado de alquimia práctica que ha llegado hasta nosotros fue escrito en el siglo III d.C. por un griego egipcio, Zosimos de Panopolis. Típico de la escritura alquímica, y de algunos químicos modernos, el texto es bastante oscuro y hace amplia referencia a las contribuciones de los primeros trabajadores.
Pero mientras que las revistas modernas presentan los últimos descubrimientos, una de las premisas clave de la alquimia era una profundamente pesimista: que los antiguos habían tenido una vez las llaves del universo pero que este conocimiento se había perdido y tenía que ser redescubierto.

Zosimos no fue una excepción, y cita extensamente los trabajos de una mujer conocida como María Hebraica – María la Judía – que es descrita por otros escritores como Miriam, la hermana de Moisés. Las fechas precisas de María son inciertas pero parece haber vivido un par de generaciones antes de Zosimos, probablemente también en Egipto. Su parentesco con el profeta del Antiguo Testamento es improbable, pero las leyendas que vinculan las figuras bíblicas y las deidades griegas con la alquimia eran comunes – tales pedigríes sólo agregaban mística y autenticidad a las obras alquímicas.
La contribución de María la judía
En su tratado, Zosimos atribuye a María tres piezas cruciales de equipamiento. La primera se conoció como el «balneum mariae» o baño de María, un contenedor de doble pared, equipado con pies que podían estar sobre el fuego. Con el recipiente exterior lleno de agua, el material a transmutar podía ser colocado en la cámara interior donde su temperatura se mantendría a no más del punto de ebullición del agua.
El segundo dispositivo era el kerotakis, un simple dispositivo de reflujo de dos cámaras. Luego estaba el notable tribikos, o alambique de tres cabezas, que permitía recoger un destilado de tres salidas a la vez.

Si la destilación ha evolucionado, el baño maría sigue siendo en gran medida lo que era, el método de elección para el calentamiento suave (el estiércol está menos disponible en los laboratorios hoy en día), en particular para las destilaciones en las que existe el riesgo de que se produzcan choques, como en el caso del evaporador rotativo.
En la cocina, un baño maría colocado en el horno permite el delicado fraguado de los pudines y timbales húmedos, mientras que el calor no moderado de la parte superior impulsa las reacciones de Maillard y de caramelización que dan costras sabrosas. Mis amigos mezcladores moleculares Tony y Giles prefieren el baño maría para infundir sus alcoholes de cóctel con sabores exóticos. La gastronomía molecular, también, no es nada sin control.
Para más información Classic Kit: Mary’s bath
Como citar este artículo:
APA: (2018-05-24). Baño de Maria. Recuperado de https://quimicafacil.net/infografias/material-de-laboratorio/bano-de-maria/
ACS: . Baño de Maria. https://quimicafacil.net/infografias/material-de-laboratorio/bano-de-maria/. Fecha de consulta 2025-10-11.
IEEE: , "Baño de Maria," https://quimicafacil.net/infografias/material-de-laboratorio/bano-de-maria/, fecha de consulta 2025-10-11.
Vancouver: . Baño de Maria. [Internet]. 2018-05-24 [citado 2025-10-11]. Disponible en: https://quimicafacil.net/infografias/material-de-laboratorio/bano-de-maria/.
MLA: . "Baño de Maria." https://quimicafacil.net/infografias/material-de-laboratorio/bano-de-maria/. 2018-05-24. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net