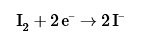Actualizado en septiembre 15, 2021
Tiempo de lectura estimado: 8 minutos
La vitamina C, conocido químicamente como ácido ascórbico, es un factor importante en una dieta balanceada. La historia de la vitamina C está unida al escorbuto, probablemente la primera enfermedad reconocida como deficiencia de un componente en el cuerpo. Sus síntomas incluyen cansancio, hemorragia masiva en tejidos y encías, debilidad general y diarrea, lo que conlleva generalmente a la muerte. El escorbuto es exclusivo de los conejillos de indias, varias especies de primates y el ser humano.
Análisis de la cantidad de vitamina C
La vitamina C es uno de los compuestos esenciales para el correcto funcionamiento del organismo, se obtiene a través de la ingesta de alimentos ricos en esta sustancia. La mayoría de las especies animales tienen enzimas capaces de catalizar la oxidación de L-gluconolactona a L-ácido ascórbico, que les permite sintetizar la cantidad de vitamina C que necesitan para sus procesos biológicos.
En 1536, Jacques Cartier, explorador francés, reportó los efectos curativos milagrosos de las infusiones de la corteza de pino y agujas empleadas por los nativos americanos. Ahora es conocido que dichos materiales son ricos en vitamina C, sin embargo, aun tuvieron que pasar cerca de 400 años para el aislamiento de la vitamina C. a finales del siglo XIV, la marina británica ordenó el uso de limas a bordo de los barcos para prevenir el escorbuto. Para esa época, el escorbuto en los marineros era un serio problema con tasas de mas del 50% de perdida de marineros en viajes largos.
La vitamina C consiste en una cadena de seis carbonos, relacionada químicamente a la glucosa. Se aisló en 1928 por el científico de origen Húngaro Albert Szent-Györgyi y caracterizado estructuralmente por Walter Norman Haworth en 1933.
En este experimento se determinará la cantidad de vitamina C en una muestra como puede ser una bebida, muestra de frutas, suplemento alimenticio o muestra comercial de vitamina C para análisis. La determinación se realizará empleando las siguientes reacciones;

La primera reacción genera yodo acuoso, que oxida la vitamina C en la segunda reacción. Ambas reacciones necesitan de condiciones ácidas, que se logran al agregar ácido clorhídrico diluido a la mezcla reactante. También se requiere de una fuente de iones yoduro disueltos, que serán proveídos adicionando yoduro de potasio solido a la reacción.
La segunda reacción es una reacción de oxido-reducción y las dos semireacciones que se presentan son;
Unas gotas de solución de almidón se emplearán como indicador del punto final de titulación. Cuando la vitamina C se oxide completamente, los iones yodo reaccionaran con los iones yoduro generando un complejo azul, que indicara el punto final de la titulación.
Materiales
- Bureta de 50 mL
- Mortero y pistilo
- Soporte universal
- Pinzas para bureta
- 3 Erlenmeyer de 250 mL
- 2 pipetas Pasteur
- Plancha de agitación
- 3 agitadores magnéticos
Reactivos
- Solución 0.01 M de yodato potásico
- Yoduro potásico solido
- Solución 1 M de ácido clorhídrico
- Solución de almidón 0.5%
- Estándar de laboratorio de vitamina C
Procedimiento
Realizar un montaje para titulación empleando el soporte universal, pinza para bureta, bureta y la plancha para agitación. En caso de no disponer plancha de agitación, se pueden agitar los Erlenmeyer con movimientos curvos de la mano.
Estandarización de la solución de yodato de potasio
Es necesario estandarizar la concentración de la solución de yodato de potasio para conocer su concentración real, para esto, se empleará una cantidad conocida de patrón de vitamina C que será valorada con la solución de yodato. Se debe calcular cuántos gramos de estándar de vitamina C se deben emplear para ser titulados con 25 – 35 mL de solución de yodato de potasio.
Estandarización de la solución de yodato de potasio
Calcular la masa aproximada de ácido ascórbico (vitamina C) para la valoración de 25 – 35 mL de solución de yodato de potasio
Pesar la masa de ácido ascórbico directamente en un Erlenmeyer de 250 mL. Anotar la masa exacta con tres espacios decimales.
Disolver el ácido ascórbico con 50 o 100 mL de agua desionizada en el Erlenmeyer.
AnuncioAgregar 0.5 – 0.6 g de yoduro de potasio, 5 – 6 mL de ácido clorhídrico 1M y 3 – 4 gotas de solución de almidón 0.5% al Erlenmeyer. Agitar vigorosamente.
Iniciar la titulación. A medida que la solución de yodato potásico sea adicionada, se vera la formación de un color azul oscuro o amarillo. Agitar constantemente para desvanecer el color. El punto final será cuando el color azul oscuro se mantenga por más de 20 segundos de agitación.
Calcular la molaridad de la muestra. Repetir el procedimiento por triplicado y hasta obtener una diferencia entre los cálculos inferior a ±0.0005 M
Cantidad de vitamina C en una tableta de suplemento (estándar de control interno)
- Tomar dos tabletas de vitamina C masticables
- Pesar cada tableta de manera individual y determinar la masa promedio de la tableta
- Moler las tabletas hasta obtener polvo fino en el mortero
- Pesar aproximadamente 0.20 – 0.25 gramos del polvo obtenido directamente en un Erlenmeyer de 250 mL. Anotar la masa adicionada.
- Disolver la muestra con 100 mL de agua desionizada y agitar bien. Dependiendo de los excipientes que pueden contener las tabletas, puede observarse polvo blanco en el fondo del Erlenmeyer, que corresponde a carbonato de calcio.
- Agregar 0.5 – 0.6 g de yoduro de potasio, 5 – 6 mL de ácido clorhídrico 1M y 3 – 4 gotas de solución de almidón 0.5% al Erlenmeyer. Agitar vigorosamente.
- Iniciar la titulación. A medida que la solución de yodato potásico sea adicionada, se vera la formación de un color azul oscuro o amarillo. Agitar constantemente para desvanecer el color. El punto final será cuando el color azul oscuro se mantenga por más de 20 segundos de agitación.
- Realizar la medición por triplicado. Si en la primera titulación se gastan menos de 20 mL de solución de yodato de potasio, aumentar la cantidad de masa del polvo empleado en las siguientes titulaciones.
- Calcular los miligramos de acido ascórbico por gramo de muestra y empleando la masa promedio de una tableta, determinar los miligramos de vitamina C contenida en cada tableta. Para los cálculos, usar la concentración determinada en la estandarización de la solución de yodato potásico.
Determinación de contenido de vitamina C en jugo de frutas, productos de salud o polvos para refresco.
Muestras solidas
- Pulverizar las muestras empleando el mortero, si la muestra es un polvo, se puede emplear directamente.
- Pesar suficiente muestra para tener cerca de 100 mg de ácido ascórbico. Para realizar el calculo se debe tener en cuenta la cantidad declarada de ácido ascórbico en la etiqueta del producto o la cantidad promedio de contenido que se referencia en la literatura.
- Agregar la muestra a un Erlenmeyer de 250 mL con 50 – 100 mL de agua desionizada.
- Agregar 0.5 – 0.6 g de yoduro de potasio, 5 – 6 mL de ácido clorhídrico 1M y 3 – 4 gotas de solución de almidón 0.5% al Erlenmeyer. Agitar vigorosamente.
- Iniciar la titulación. A medida que la solución de yodato potásico sea adicionada, se vera la formación de un color azul oscuro o amarillo. Agitar constantemente para desvanecer el color. El punto final será cuando el color azul oscuro se mantenga por más de 20 segundos de agitación.
- Realizar dos mediciones más. Si en la primera titulación requiere menos de 20 mL de yodato de potasio, aumentar la masa a ensayar.
- Calcular los miligramos de ácido ascórbico por gramo de muestra. Para los cálculos emplear la molaridad determinada en la estandarización de la solución de yodato de potasio.
Muestras liquidas
- Si se va a ensayar con jugo con pulpa de fruta, filtrar el liquido para retirar la pulpa empleando una tela o papel filtro.
- Usando una probeta, medir 100 mL de muestra liquida. Anotar el volumen.
- Agregar el líquido a un Erlenmeyer de 250 mL
- Agregar 0.5 – 0.6 g de yoduro de potasio, 5 – 6 mL de ácido clorhídrico 1M y 3 – 4 gotas de solución de almidón 0.5% al Erlenmeyer. Agitar vigorosamente.
- Iniciar la titulación. A medida que la solución de yodato potásico sea adicionada, se vera la formación de un color azul oscuro o amarillo. Agitar constantemente para desvanecer el color. El punto final será cuando el color azul oscuro se mantenga por más de 20 segundos de agitación. Si se está valorando un jugo, en ocasiones el color azul toma más tiempo en desaparecer, entonces el punto final de valoración será cuando el color permanezca.
- Realizar dos mediciones más. Si en la primera titulación requiere menos de 20 mL de yodato de potasio, aumentar el volumen a ensayar.
- Calcular los miligramos de ácido ascórbico por mililitro de jugo. Para los cálculos emplear la molaridad determinada en la estandarización de la solución de yodato de potasio.
Después del experimento
Realizar los cálculos correspondientes a la estandarización de la solución de yodato de potasio. Calcular la cantidad en miligramos del contenido de ácido ascórbico (vitamina C) en las muestras examinadas. Comparar los valores obtenidos con los reportados en las etiquetas o en la literatura, ¿Cuál valor es mayor? ¿Qué implicaciones tiene un valor mayor o menor que el reportado? ¿Qué interferencias se pueden esperar al realizar la medición en alimentos? ¿Qué otras técnicas se emplean para la medición de la cantidad de vitamina C en la muestras?
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la practica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Vitamin C Analysis (Experiment)
Clasificación
Nivel: Universitario
Tipo: Practica de enseñanza
Riesgo: bajo
Como citar este artículo:
APA: (2018-10-31). Análisis del contenido de vitamina C. Recuperado de https://quimicafacil.net/manual-de-laboratorio/analisis-del-contenido-de-vitamina-c/
ACS: . Análisis del contenido de vitamina C. https://quimicafacil.net/manual-de-laboratorio/analisis-del-contenido-de-vitamina-c/. Fecha de consulta 2024-07-27.
IEEE: , "Análisis del contenido de vitamina C," https://quimicafacil.net/manual-de-laboratorio/analisis-del-contenido-de-vitamina-c/, fecha de consulta 2024-07-27.
Vancouver: . Análisis del contenido de vitamina C. [Internet]. 2018-10-31 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/analisis-del-contenido-de-vitamina-c/.
MLA: . "Análisis del contenido de vitamina C." https://quimicafacil.net/manual-de-laboratorio/analisis-del-contenido-de-vitamina-c/. 2018-10-31. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net