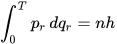Tiempo de lectura estimado: 5 minutos
El modelo atómico de Schrodinger es un modelo cuántico no relativista. En este modelo los electrones se contemplaban originalmente como una onda estacionaria de materia cuya amplitud decaía rápidamente al sobrepasar el radio atómico.
Antecedentes del modelo de Schrodinger
En 1924, Louis de Broglie propuso que todas las partículas en movimiento, especialmente las subatómicas como los electrones, exhiben un cierto grado de comportamiento ondulatorio. Erwin Schrödinger, fascinado por esta idea, exploró si el movimiento de un electrón en un átomo podía explicarse mejor como una onda que como una partícula.
La ecuación de Schrödinger, publicada en 1926, describe un electrón como una función de onda en lugar de como una partícula puntual. Este enfoque predijo elegantemente muchos de los fenómenos espectrales que el modelo de Bohr no pudo explicar. Aunque este concepto era matemáticamente conveniente, era difícil de visualizar y se enfrentaba a la oposición, así surgía el modelo atómico de Schrodinger.
Uno de sus críticos, Max Born, propuso en cambio que la función de onda de Schrödinger no describía el electrón sino más bien todos sus posibles estados, y por lo tanto se podía utilizar para calcular la probabilidad de encontrar un electrón en cualquier lugar dado alrededor del núcleo.
Esto reconcilió las dos teorías opuestas de los electrones de partículas frente a los de ondas y se introdujo la idea de la dualidad onda-partícula. Esta teoría afirmaba que el electrón puede exhibir las propiedades tanto de una onda como de una partícula. Por ejemplo, puede ser refractado como una onda, y tiene masa como una partícula.
Una consecuencia de la descripción de los electrones como formas de onda es que es matemáticamente imposible derivar simultáneamente la posición y el momento de un electrón. Esto se conoció como el principio de incertidumbre de Heisenberg por el físico teórico Werner Heisenberg, quien lo describió por primera vez y lo publicó en 1927.
Esto invalidó el modelo de Bohr, con sus órbitas circulares bien definidas. El modelo moderno del átomo describe las posiciones de los electrones en un átomo en términos de probabilidades. Un electrón puede encontrarse potencialmente a cualquier distancia del núcleo, pero, dependiendo de su nivel de energía, existe con mayor frecuencia en ciertas regiones alrededor del núcleo que en otras; este patrón se denomina su orbital atómico. Los orbitales vienen en una variedad de formas -esfera, mancuerna, toro, etc.- con el núcleo en el medio.
Características del modelo de Schrödinger
El modelo atómico de Schrodinger concebía originalmente los electrones como ondas de materia. Así la ecuación se integraría como la ecuación ondulatoria que describía la evolución en el tiempo y el espacio de dicha onda material. Más tarde Max Born propuso una interpretación probabilística de la difunción de onda de los electrones.
Esta nueva interpretación es compatible con los electrones concebidos como partículas cuasipuntuales cuya probabilidad de presencia en una determinada región viene dada por la integral del cuadrado de la función de onda en una región. Es decir, en la interpretación posterior del modelo, este era un modelo probabilista que permitía hacer predicciones empíricas, pero en el que la posición y la cantidad de movimiento no pueden conocerse simultáneamente, por el principio de incertidumbre. Así mismo el resultado de ciertas mediciones no están determinadas por el modelo, sino solo el conjunto de resultados posibles y su distribución de probabilidad.
Ecuación de Schrödinger
La ecuación de Schrödinger es una ecuación diferencial parcial lineal que describe la función de onda o función de estado de un sistema de mecánica cuántica, como el modelo atómico de Schrodinger. Es un resultado clave en la mecánica cuántica, y su descubrimiento fue un hito significativo en el desarrollo del tema. La ecuación lleva el nombre de Erwin Schrödinger, quien postuló la ecuación en 1925, y la publicó en 1926, formando la base del trabajo que le valió el Premio Nobel de Física en 1933.
En la mecánica clásica, la segunda ley de Newton (F = m*a) se utiliza para hacer una predicción matemática sobre el camino que tomará un sistema físico dado en el tiempo siguiendo un conjunto de condiciones iniciales conocidas. Resolviendo esta ecuación se obtiene la posición y el impulso del sistema físico en función de la fuerza externa F en el sistema. Esos dos parámetros son suficientes para describir su estado en cada instante de tiempo. En la mecánica cuántica, la analogía de la ley de Newton es la ecuación de Schrödinger.
El concepto de función de onda es un postulado fundamental de la mecánica cuántica; la función de onda define el estado del sistema en cada posición espacial, y el tiempo. Utilizando estos postulados, la ecuación de Schrödinger puede derivarse del hecho de que el operador de evolución temporal debe ser unitario, y por lo tanto debe ser generado por el exponencial de un operador auto-unido, que es el cuántico Hamiltoniano. Esta derivación se explica a continuación.
En la interpretación de Copenhague de la mecánica cuántica, la función de onda es la descripción más completa que se puede dar de un sistema físico. Las soluciones a la ecuación de Schrödinger describen no sólo los sistemas moleculares, atómicos y subatómicos, sino también los sistemas macroscópicos, posiblemente incluso todo el universo.
La ecuación de Schrödinger no es la única forma de estudiar los sistemas de mecánica cuántica y hacer predicciones. Las otras formulaciones de la mecánica cuántica incluyen la mecánica matricial, introducida por Werner Heisenberg, y la formulación integral del camino, desarrollada principalmente por Richard Feynman. Paul Dirac incorporó la mecánica matricial y la ecuación de Schrödinger en una sola formulación.
Para más información Erwin Schrödinger
Como citar este artículo:
APA: (2018-05-24). Modelo atómico de Schrodinger. Recuperado de https://quimicafacil.net/infografias/modelo-atomico-de-schrodinger/
ACS: . Modelo atómico de Schrodinger. https://quimicafacil.net/infografias/modelo-atomico-de-schrodinger/. Fecha de consulta 2025-10-11.
IEEE: , "Modelo atómico de Schrodinger," https://quimicafacil.net/infografias/modelo-atomico-de-schrodinger/, fecha de consulta 2025-10-11.
Vancouver: . Modelo atómico de Schrodinger. [Internet]. 2018-05-24 [citado 2025-10-11]. Disponible en: https://quimicafacil.net/infografias/modelo-atomico-de-schrodinger/.
MLA: . "Modelo atómico de Schrodinger." https://quimicafacil.net/infografias/modelo-atomico-de-schrodinger/. 2018-05-24. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net