Actualizado en mayo 20, 2024
Tiempo de lectura estimado: 8 minutos
El modelo atómico de Lewis, también conocido como estructura de Lewis o estructura de puntos de electrones, es un concepto fundamental en química que proporciona una representación visual de la unión entre átomos dentro de una molécula y los pares de electrones solitarios que pueden existir. Desarrollado por Gilbert N. Lewis en 1916, este modelo enfatiza el papel de los electrones de valencia en la unión química, ofreciendo un método sencillo para predecir la estructura molecular, la reactividad y la naturaleza de los enlaces químicos. El modelo de Lewis marca una desviación significativa de las teorías atómicas anteriores al enfocarse explícitamente en los pares de electrones y sus interacciones.
Historia del modelo
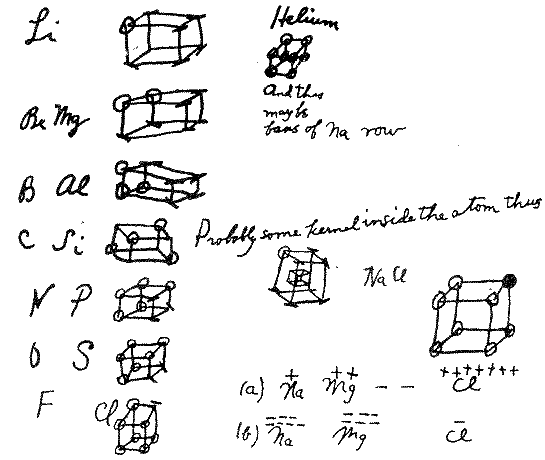
En el artículo “The atom and the molecule”* Gilbert N. Lewis publicó su teoría sobre el modelo de átomo cubico para poder explicar el fenómeno de la valencia atómica. A pesar de que rápidamente se abandonó en favor de modelos más desarrollados, tiene una importancia histórica gracias a su aporte en el entendimiento de los enlaces químicos.
Características del modelo atómico de Lewis
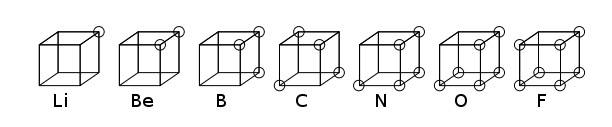
El átomo cúbico fue un modelo atómico temprano en el que los electrones se posicionaban en las ocho esquinas de un cubo en un átomo o molécula no polar. Esta teoría fue desarrollada en 1902 por Gilbert N. Lewis y publicada en 1916 en el artículo «El átomo y la molécula» y utilizada para explicar el fenómeno de valencia.
La teoría de Lewis se basaba en la regla de Abegg. Fue desarrollado en 1919 por Irving Langmuir como el átomo octeto cúbico. La siguiente figura muestra representaciones estructurales para elementos de la segunda fila de la tabla periódica
Aunque el modelo cúbico del átomo se abandonó pronto en favor del modelo de mecánica cuántica basado en la ecuación de Schrödinger, y por lo tanto ahora es principalmente de interés histórico, representó un importante paso hacia la comprensión del enlace en la química. El artículo de 1916 de Lewis también introdujo el concepto del par de electrones en el enlace covalente, la regla del octeto, y la ahora llamada estructura de Lewis.
Los enlaces en el modelo de átomo cúbico
Los enlaces covalentes simples se forman cuando dos átomos comparten un borde, como en la estructura C de abajo. Esto resulta en el intercambio de dos electrones. Los enlaces iónicos se forman por la transferencia de un electrón de un cubo a otro sin compartir un borde (estructura A). Un estado intermedio en el que sólo se comparte un rincón (estructura B) también fue postulado por Lewis.

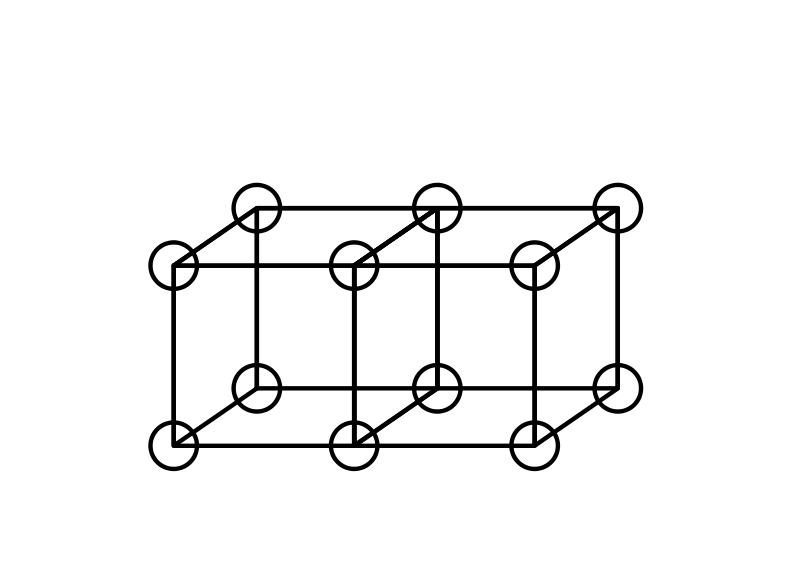
Los enlaces dobles se forman al compartir una cara entre dos átomos cúbicos. Esto resulta en compartir cuatro electrones:
El modelo de átomo cúbico no pudo explicar los enlaces triples, porque no hay forma de que dos cubos compartan tres bordes paralelos. Lewis sugirió que los pares de electrones en los enlaces atómicos tienen una atracción especial, que dan lugar a una estructura tetraédrica, como en la siguiente figura (la nueva ubicación de los electrones está representada por los círculos punteados en el centro de los bordes gruesos). Esto permite la formación de un vínculo simple al compartir una esquina, un vínculo doble al compartir un borde, y un vínculo triple al compartir una cara. También explica la libre rotación alrededor de los enlaces simples y la geometría tetraédrica del metano.

Problemas con el modelo atómico de Lewis
Aunque a primera vista, el modelo del átomo cubico propuesto por Lewis pareciera responder a las observaciones hechas hasta el momento sobre la naturaleza del átomo había dos principales problemas que no podía resolver.
El modelo era consistente con la formación del enlace simple Cl-Cl para completar el octeto de dos átomos de cloro compartiendo dos electrones a lo largo de una arista. También era consistente con la formación del doble enlace O=O compartiendo cuatro electrones a lo largo de una cara. Pero no había forma de que fuera consistente con la formación de un triple enlace en el N2.
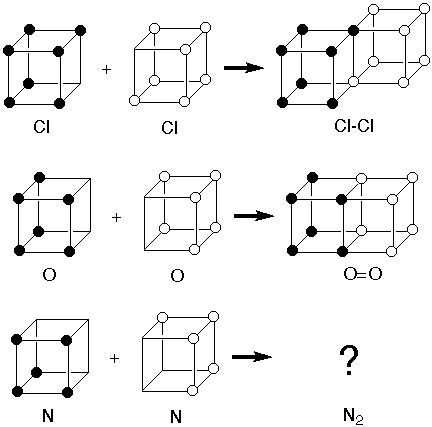
Lewis sorteó ágilmente este obstáculo suponiendo que, en lugar de tener sitios individuales de electrones en las esquinas de un cubo, había pares de sitios de electrones en las esquinas de un tetraedro. Así, dos tetraedros podían compartir tres esquinas para formar un triple enlace. Esto también parecía coherente con la geometría tetraédrica del carbono tetravalente que ya era conocida.
Hay una objeción aún más fundamental a la idea misma de cualquier estructura estática para el átomo.
El problema con el átomo cubico estático de Lewis
En 1839, Samuel Earnshaw demostró que ningún sistema regido por las leyes de fuerza del cuadrado inverso (es decir, donde la energía es proporcional a 1/r y la fuerza, la derivada de la energía a 1/r2) puede poseer el mínimo local de energía que sería necesario para que una partícula tuviera una ubicación estable. Muchas fuerzas importantes son de la forma 1/r2. Entre ellas están la gravedad, la interacción entre cargas y la interacción entre polos magnéticos.
Lewis, al igual que los destacados físicos J.J. Thomson y James Jeans, especuló con que, en distancias muy pequeñas, como las que hay dentro de un átomo, la energía de las cargas que interactúan podría dejar de obedecer la Ley de Coulomb (E = q1q2/r2), y que esto permitiría escapar de la restricción de Earnshaw. En 1923 Thomson escribió:
… si [la atracción electrón-nuclear] variara estrictamente como el cuadrado inverso de la distancia sabemos por el teorema de Earnshaw que no es posible ninguna configuración estable en la que los electrones estén en reposo u oscilando alrededor de posiciones de equilibrio …
Supondré que la ley de la fuerza entre una carga positiva y un electrón se expresa mediante la ecuación F=Ee/r2(1-c/r)
… entonces un número de electrones puede estar en equilibrio alrededor de una carga positiva sin describir necesariamente órbitas alrededor de ella.
J. J. Thomson,The Electron in Chemistry (1923)
Limitaciones energéticas
Obsérvese que Thomson multiplica arbitrariamente la Ley de la Fuerza de Coulomb por un factor que es esencialmente la unidad para una gran distancia r, pero cambia el signo de la fuerza cuando r se hace más pequeño que c, una constante que él supuso que era aproximadamente el radio de un átomo. Esto habría sido brillante, si hubiera sido correcto.
En el mismo año Lewis escribió:
…si utilizamos el electrón como carga de prueba para determinar las propiedades del campo eléctrico más simple posible, es decir, el campo alrededor de un núcleo de hidrógeno, parece que encontramos que este campo no es un continuo sino que es sorprendentemente discontinuo.
En lugar de pensar en un campo eléctrico como un continuo, deberíamos considerarlo más bien como una malla intensamente complicada.
G.N.Lewis,Valence and the Structure of Atoms and Molecules (1923)
Pero Lewis, Thomson y Jeans estaban equivocados. La ley de Coulomb se aplica a distancias muy pequeñas (<10-20 veces el tamaño de un átomo). Un conjunto de cargas puntuales no puede tener una estructura estática estable, octeto cúbico o lo que sea, en ausencia de fuerzas de tipo de Coulomb.
Por supuesto, las partículas de un átomo no son estáticas. Lo que resultó ser un error de la física clásica aplicada a sistemas tan pequeños fue su formulación de la energía cinética como 1/2 mv2. Esto fue corregido sólo tres años después, en 1926, por la Mecánica Cuántica.
Impacto del modelo de Lewis
El desarrollo del modelo de Lewis fue influenciado por y, a su vez, influyó en varias otras teorías atómicas. Por ejemplo, se basó en el trabajo anterior de J.J. Thomson y su modelo de «budín de ciruelas», que conceptualizaba los electrones incrustados dentro de una esfera cargada positivamente. Sin embargo, el modelo de Lewis proporcionó un marco más detallado y práctico para entender los enlaces químicos, complementando las ideas mecánico-cuánticas que surgieron más tarde con la ecuación de Schrödinger y el desarrollo de la teoría del orbital molecular.
Además, el modelo de Lewis sentó las bases para la teoría de la Repulsión de Pares de Electrones de la Capa de Valencia (VSEPR), que amplió el concepto de repulsión de pares de electrones para predecir las formas tridimensionales de las moléculas.
En esencia, el modelo atómico de Lewis sirve como un puente entre las teorías atómicas clásicas y modernas, integrando la noción de pares de electrones en el contexto más amplio de la estructura atómica y molecular. Su simplicidad y eficacia para explicar los enlaces químicos lo convierten en una piedra angular de la educación química.
Para más información The Cubical Atom
Como citar este artículo:
APA: (2018-05-24). Modelo atómico de Lewis. Recuperado de https://quimicafacil.net/infografias/teorias-y-modelos-atomicos/modelo-atomico-de-lewis/
ACS: . Modelo atómico de Lewis. https://quimicafacil.net/infografias/teorias-y-modelos-atomicos/modelo-atomico-de-lewis/. Fecha de consulta 2024-07-27.
IEEE: , "Modelo atómico de Lewis," https://quimicafacil.net/infografias/teorias-y-modelos-atomicos/modelo-atomico-de-lewis/, fecha de consulta 2024-07-27.
Vancouver: . Modelo atómico de Lewis. [Internet]. 2018-05-24 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/infografias/teorias-y-modelos-atomicos/modelo-atomico-de-lewis/.
MLA: . "Modelo atómico de Lewis." https://quimicafacil.net/infografias/teorias-y-modelos-atomicos/modelo-atomico-de-lewis/. 2018-05-24. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net