Tiempo de lectura estimado: 3 minutos
Un condensador de Davies, también conocido como condensador de doble superficie o de doble chaqueta, es similar al condensador de Liebig, pero con tres tubos concéntricos de vidrio en lugar de dos, lo que permite al liquido de refrigeracion circular por dos superficies y extraer más calor del vapor.
El liquido refrigerante circula tanto en la cubierta exterior como en el tubo central. Esto aumenta la superficie de enfriamiento, de modo que el condensador puede ser más corto que un condensador Liebig equivalente.
Según Alan Gall, archivero del Instituto de Ciencia y Tecnología de Sheffield, Inglaterra, el catálogo de 1981 de Adolf Gallenkamp & Co. de Londres (fabricantes de aparatos científicos) afirma que el condensador de Davies fue inventado por James Davies, un director de la empresa Gallenkamp. En 1904, Gallenkamp ofrecía a la venta los «Condensadores de Davies»:. En 1920, Gallenkamp incluyó a «J. Davies» en la lista de directores de la compañía.
Historia
Desarrollado aparentemente por James Davies a finales del siglo XIX o a inicios del siglo XX para la Adolf Gallenkamp & Co, productora de instrumentación de laboratorio inglesa. En 1904 ya se pueden observar en los catálogos de dicha empresa condensadores Davies para su venta.
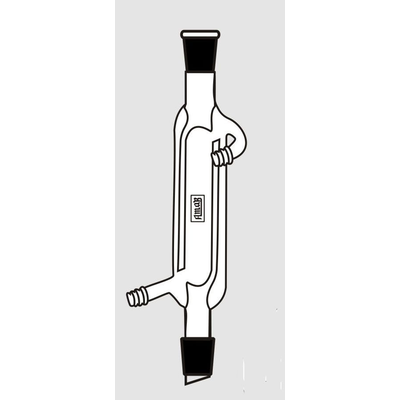
Es básicamente una mejora del condensador de Liebig, tres cilindros concéntricos son unidos haciendo que el líquido de refrigeración circule entre el cilindro externo y el intermedio y a través del cilindro interno. El vapor se condensa en el espacio formado entre el cilindro interno y el intermedio, aumentando el área de condensación en casi el doble de un condensador Liebig del mismo largo.
Uso y eficiencia del condensador Davies
Debido a su gran área de condensación, se emplean para destilación y reflujo de vapores con bajos puntos de ebullición, sin embargo, requiere un alto flujo de líquido de refrigeración para aprovechar toda el área, al igual que una presión constante en el flujo.

Si se compara con condensadores de diseño sencillo como el condensador Liebig o condensador recto, o con un condensador Allihn o de rosario, el condensador Davies es más eficiente gracias al aumento en el área de intercambio de calor entre el vapor y el liquido de refrigeración. Sin embargo, debido a la disminución del área transversal de flujo de vapor, es necesario tener cuidado con la cantidad de vapor que se desea enfriar con este tipo de condensador.
Debido a su diseño complejo, el costo de un condensador Davies es mayor en comparación a un condensador Liebig, también es necesario tener mayores cuidados cuando se manipula y limpia para evitar daños a su compleja estructura.
Para más información Types of Condensers
Como citar este artículo:
APA: (2018-07-02). Condensador de Davies. Recuperado de https://quimicafacil.net/infografias/material-de-laboratorio/condensador-de-davies/
ACS: . Condensador de Davies. https://quimicafacil.net/infografias/material-de-laboratorio/condensador-de-davies/. Fecha de consulta 2025-10-11.
IEEE: , "Condensador de Davies," https://quimicafacil.net/infografias/material-de-laboratorio/condensador-de-davies/, fecha de consulta 2025-10-11.
Vancouver: . Condensador de Davies. [Internet]. 2018-07-02 [citado 2025-10-11]. Disponible en: https://quimicafacil.net/infografias/material-de-laboratorio/condensador-de-davies/.
MLA: . "Condensador de Davies." https://quimicafacil.net/infografias/material-de-laboratorio/condensador-de-davies/. 2018-07-02. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net