Tiempo de lectura estimado: 5 minutos
La tabla periódica es una disposición de los elementos químicos, que se organizan sobre la base de sus números atómicos, configuraciones de electrones y propiedades químicas recurrentes.
Los elementos se presentan en orden de aumento del número atómico. La forma estándar (pero no única) de la tabla consiste en una cuadrícula con filas llamadas períodos y columnas llamadas grupos.
La historia de la tabla periódica refleja más de dos siglos de crecimiento en la comprensión de las propiedades químicas, con importantes contribuciones de Antoine-Laurent de Lavoisier, Johann Wolfgang Döbereiner, John Newlands, Julius Lothar Meyer, Dmitri Mendeleev y Glenn T. Seaborg.
Los primeros elementos
Algunos elementos (como el platino, el mercurio, el estaño y el zinc) se conocen desde la antigüedad, ya que se encuentran en su forma nativa y son relativamente fáciles de extraer con herramientas primitivas.
Alrededor del año 330 a.C., el filósofo griego Aristóteles propuso que todo se compone de una mezcla de una o más raíces, una idea que originalmente había sido sugerida por el filósofo siciliano Empédocles.
Las cuatro raíces, que más tarde fueron rebautizadas como elementos por Platón, fueron tierra, agua, aire y fuego. Ideas similares sobre estos cuatro elementos también existían en otras tradiciones antiguas, como la filosofía india.
La historia de la tabla periódica es también una historia del descubrimiento de los elementos químicos.
La primera persona en la historia en descubrir un nuevo elemento fue Hennig Brand, un comerciante alemán en quiebra. Brand trató de descubrir la Piedra Filosofal – un objeto mítico que se suponía que convertiría metales comunes baratos en oro.
En 1669 (o tal vez más tarde), sus experimentos con orina humana destilada dieron lugar a la producción de una sustancia blanca brillante, a la que llamó «fuego frío» (kaltes Feuer) y mantuvo su descubrimiento en secreto hasta 1680, cuando Robert Boyle redescubrió el fósforo y publicó sus hallazgos.
El descubrimiento del fósforo ayudó a plantear la cuestión de lo que significaba para una sustancia ser un elemento.
En 1661, Boyle definió un elemento como «aquellos cuerpos primitivos y simples de los que se dice que están compuestos los cuerpos mixtos y en los que finalmente se resuelven»
La propuesta de Lavoisier
El Traité Élémentaire de Chimie (Tratado Elemental de Química) de Antoine Lavoisier, escrito en 1789 y traducido por primera vez al inglés por el escritor Robert Kerr, está considerado como el primer libro de texto moderno sobre química.
Lavoisier definió un elemento como una sustancia que no puede ser descompuesta en una sustancia más simple por una reacción química. Esta simple definición sirvió durante un siglo y duró hasta el descubrimiento de partículas subatómicas.
El libro de Lavoisier contenía una lista de «sustancias simples» que Lavoisier creía que no se podían desglosar más, que incluía oxígeno, nitrógeno, hidrógeno, fósforo, mercurio, zinc y azufre, que formaban la base de la moderna lista de elementos.
La lista de Lavoisier también incluía `ligero’ y `calórico’, que en ese momento se creía que eran sustancias materiales. Clasificó estas sustancias en metales y no metales.
Mientras que muchos químicos importantes se negaron a creer en las nuevas revelaciones de Lavoisier, el Tratado elemental de Lavoisier fue escrito lo suficientemente bien como para convencer a la generación más joven. Sin embargo, las descripciones que Lavoisier hace de sus elementos son incompletas, ya que sólo los clasificaba como metales y no metales.
La pista está en los números
Un primer avance hacia la tabla periódica se dio en 1815, Cuando el médico y químico inglés William Prout notó que los pesos atómicos parecían ser múltiplos de los del hidrógeno.
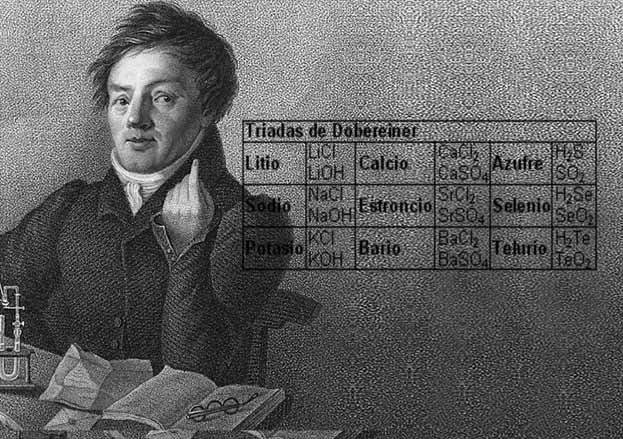
En 1817, Johann Wolfgang Döbereiner, un químico, comenzó a formular uno de los primeros intentos de clasificar los elementos. En 1829, encontró que podía formar algunos de los elementos en grupos de tres, con los miembros de cada grupo teniendo propiedades relacionadas. A estos grupos los llamó tríadas.
Definición de la ley de la tríada:-«Los elementos químicamente análogos dispuestos en orden creciente de sus pesos atómicos formaron grupos bien marcados de tres llamadas tríadas en las que se encontró que el peso atómico del elemento medio era generalmente la media aritmética del peso atómico de los otros dos elementos de la tríada.
- cloro, bromo y yodo
- calcio, estroncio y bario
- azufre, selenio y telurio
- litio, sodio y potasio
En 1860, una lista revisada de elementos y masas atómicas fue presentada en una conferencia en Karlsruhe. Ayudó a estimular la creación de sistemas más extensos. El primer sistema o forma de tabla periódica de este tipo surgió dos años después.
Artículos en esta serie
- Historia de la tabla periódica I
- Historia de la tabla periódica II
- Historia de la tabla periódica III
- Historia de la tabla periódica IV
- Historia de la tabla periódica IX
- Historia de la tabla periódica V
- Historia de la tabla periódica VI
- Historia de la tabla periódica VII
- Historia de la tabla periódica VIII
- Historia de la tabla periódica X
Como citar este artículo:
APA: (2018-12-03). Historia de la tabla periódica I. Recuperado de https://quimicafacil.net/infografias/historia-de-la-tabla-periodica-i/
ACS: . Historia de la tabla periódica I. https://quimicafacil.net/infografias/historia-de-la-tabla-periodica-i/. Fecha de consulta 2026-03-03.
IEEE: , "Historia de la tabla periódica I," https://quimicafacil.net/infografias/historia-de-la-tabla-periodica-i/, fecha de consulta 2026-03-03.
Vancouver: . Historia de la tabla periódica I. [Internet]. 2018-12-03 [citado 2026-03-03]. Disponible en: https://quimicafacil.net/infografias/historia-de-la-tabla-periodica-i/.
MLA: . "Historia de la tabla periódica I." https://quimicafacil.net/infografias/historia-de-la-tabla-periodica-i/. 2018-12-03. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net