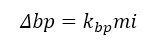Actualizado en enero 8, 2024
Tiempo de lectura estimado: 6 minutos
Las propiedades coligativas de las soluciones dependen de la concentración del soluto disueltas y no del tipo de soluto disuelto en la solución. Las propiedades coligativas son: aumento ebulloscópico (aumento del punto de ebullición), descenso crioscópico (disminución o depresión del punto de solidificación o congelación), presión osmótica y descenso de la presión de vapor.
El estudio y cuantificación de estas propiedades de las soluciones son de vital importancia en la ciencia y le ingeniería, encontrándose aplicaciones en diversos campos como alimentos, petroquímica, industria farmacéutica entre otros.
Aumento en el punto de ebullición
El aumento del punto de ebullición describe el fenómeno en el cual el punto de ebullición de un líquido, considerado como el solvente de la solución, es más alto cuando otro compuesto es agregado, lo que significa que la solución tiene un mayor punto de ebullición que el solvente puro. Si la temperatura de ebullición del solvente puro es Tste y la temperatura de la solución es Tsln, entonces el cambio en la temperatura de ebullición se puede definir como:
El punto de ebullición es una propiedad coligativa (dependiente de la presencia de partículas disueltas y su número, pero no de su identidad). Este fenómeno sucede para todos los solutos en solución, aun para soluciones ideales y no depende de alguna interacción especifica solvente- soluto.
En términos termodinámicos, el origen de la elevación del punto de ebullición es entrópico y puede ser explicado en términos de la presión de vapor o el potencial químico del solvente. En ambos casos, la explicación depende del hecho que muchas moléculas de soluto solo están presentes en la fase liquida y no entran a la fase vapor.
Teoria detras del aumento del punto de ebullición
Los cambios en el punto de ebullición de una solución pueden ser descritos en términos químicos por la siguiente ecuación
Donde kbp es la constante ebulloscópica del solvente
m es la concentración molal
i es el factor de van´t Hoff
El factor de van´t Hoff describe el numero de partículas que aporta el soluto al disolverse. De manera formal, el factor de van´t Hoff se calcula teniendo en cuenta la cantidad de iones distintos que se general al disolverse un soluto (q) y el grado de disociación del electrolito (α) según la siguiente formula:
Sin embargo, si el soluto tiene una alta constante de disociación, el valor del factor de van´t Hoff se aproxima al número de especies que se generan al disociarse en solución. Por ejemplo, para el caso del cloruro de sodio (NaCl), al disolverse, se generarán dos especies, el ion sodio y el ion cloruro, por lo que la concentración de iones en solución es el doble de la concentración del soluto. Para el caso del sulfato de sodio (Na2SO4), el factor de van´t Hoff será aproximadamente 3, ya que al disociarse en solución producirá dos cationes sodio y un anión sulfato.
Materiales
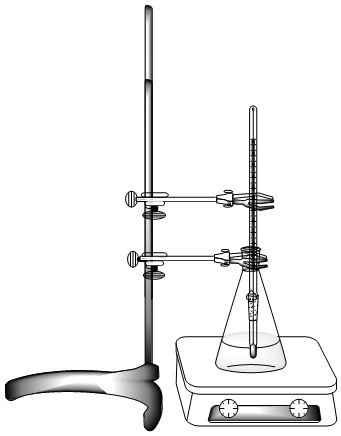
- Erlenmeyer de 125 ml
- Termómetro de laboratorio
- Plancha de calentamiento
- Soporte universal
- 2 pinzas para balón
- Perlas de ebullición
Reactivos
- 100 ml de Soluciones 2 m de cloruro de sodio (NaCl), nitrato de potasio (KNO3), sulfato de sodio (Na2SO4) y sacarosa.
Procedimiento – Aumento del punto de ebullición
Tiempo necesario: 40 minutos
Aumento en el punto de ebullición
Realice el montaje como se indica en la figura. Se debe tener en cuenta que la escala del termómetro debe ser fácilmente visible por encima de los 90°C.
 Anuncio
AnuncioColocar 25 ml de agua destilada en el Erlenmeyer e iniciar el calentamiento. Cuando se evidencie la formación de las primeras burbujas en el Erlenmeyer, observar cuidadosamente el aumento en la temperatura marcado por el termómetro. Cuando no se evidencie mas aumento en la temperatura, anotar el valor observado y suspender el calentamiento.
Esperar a que el Erlenmeyer disminuya su temperatura y desechar el líquido. Tomar 12.5 ml de una de las soluciones de trabajo y adicionar 12.5 ml de agua destilada, con lo cual la concentración de la solución final es aproximadamente 1 m. Colocar esta solución en el Erlenmeyer e iniciar el calentamiento en el montaje utilizado.
Cuando se observen la formación de las primeras burbujas, monitorizar la temperatura marcada en el termómetro. Se alcanzará la temperatura de ebullición de la solución cuando la temperatura se detenga por unos segundos y posteriormente siga su aumento, debido a la evaporación del solvente, por esta razón es importante estar atento al momento de este cambio en la velocidad de aumento de la temperatura.
Suspender el calentamiento y dejar enfriar, desechar la solución y colocar 50 ml de la solución 2 molal empleada anteriormente, nuevamente iniciar el calentamiento y medir su temperatura de ebullición.
AnuncioRepetir los anteriores pasos con las otras soluciones y anotar los valores y observaciones.
Después del experimento
Con los datos obtenidos para la temperatura de ebullición del solvente puro y de las distintas soluciones, calcular el aumento de la temperatura de la solución restando la temperatura del solvente puro obtenido (Hay que recordar que la temperatura de ebullición de un líquido o solución depende de la presión atmosférica del lugar).
¿Cuál es la diferencia entre el aumento observado entre las soluciones? ¿se puede confirmar que la cantidad de especies generadas al disolver el soluto influye sobre la diferencia observada en la temperatura de ebullición?
Para cada uno de los solutos trabajados, graficar la temperatura de ebullición versus la concentración molal de la solución. ¿Qué temperatura de ebullición se observa cuando se extrapola la gráfica hacia m=0? Determinar la pendiente de cada una de las gráficas de las soluciones, ¿Qué valores tienen las pendientes? ¿Qué significado tienen dichos valores en el experimento?
Recomendaciones de seguridad
Tener cuidado con las soluciones calientes y el manejo de la plancha de calentamiento. Manejar cuidadosamente el instrumental caliente para evitar quemaduras (el vidrio caliente se ve igual que el vidrio frio). En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la practica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Boiling Point Elevation
Como citar este artículo:
APA: (2018-12-05). Propiedades coligativas – aumento del punto ebulloscópico. Recuperado de https://quimicafacil.net/manual-de-laboratorio/aumento-del-punto-de-ebullicion/
ACS: . Propiedades coligativas – aumento del punto ebulloscópico. https://quimicafacil.net/manual-de-laboratorio/aumento-del-punto-de-ebullicion/. Fecha de consulta 2024-07-27.
IEEE: , "Propiedades coligativas – aumento del punto ebulloscópico," https://quimicafacil.net/manual-de-laboratorio/aumento-del-punto-de-ebullicion/, fecha de consulta 2024-07-27.
Vancouver: . Propiedades coligativas – aumento del punto ebulloscópico. [Internet]. 2018-12-05 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/aumento-del-punto-de-ebullicion/.
MLA: . "Propiedades coligativas – aumento del punto ebulloscópico." https://quimicafacil.net/manual-de-laboratorio/aumento-del-punto-de-ebullicion/. 2018-12-05. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net