Tiempo de lectura estimado: 5 minutos
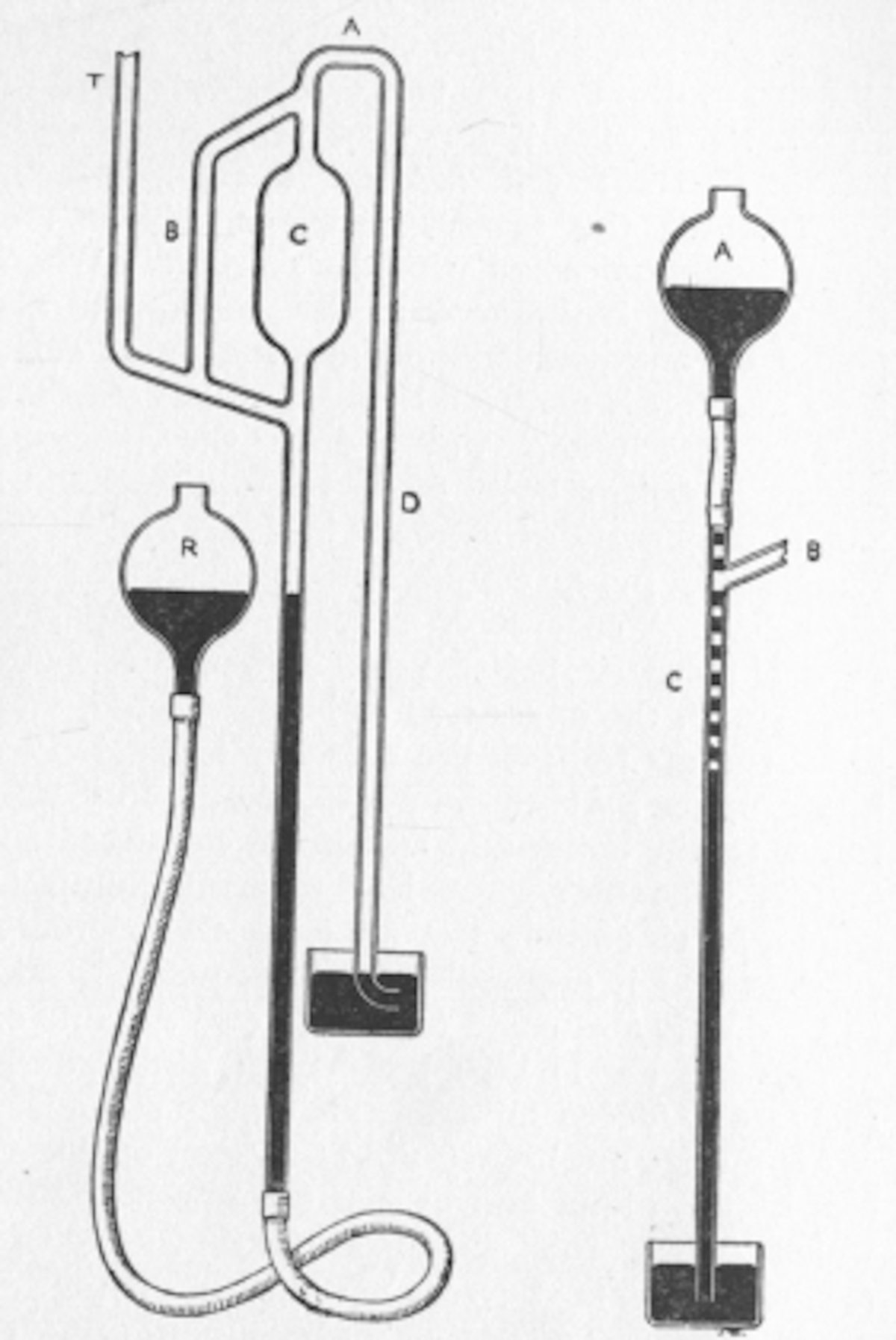
El balón de Kjeldahl es un recipiente de fondo redondo abombado y cuello largo, empleado para realizar la digestión de la muestra según la técnica de Kjeldahl para cantidad de nitrógeno
Una pieza de vidrio moderna con raíces en la industria cervecera es el matraz Kjeldahl, de fondo redondo y cuello largo para atrapar las salpicaduras del material que se está hirviendo para su análisis. Fue ideado por Johan Gustav Kjeldahl para resolver un problema relacionado con la cerveza.
En la década de 1870, la cervecería de Carlsberg en Dinamarca era propiedad y estaba dirigida con mucho éxito por J C Jacobsen, un hombre de gran cultura y perspicacia que quería que la ciencia más reciente informara y guiara su negocio. Inspirado en parte por la labor de Louis Pasteur en París, creó una fundación, en cuyo centro se encontraba un laboratorio dedicado a la investigación básica. Necesitando un químico, contrató al joven Kjeldahl.
El análisis del nitrógeno, un desafio
Nacido en 1849 en Jaegerspris, Copenhague, Kjeldahl había estudiado en el Real Politécnico de Copenhague antes de convertirse en asistente del amigo de Jacobsen, C T Barfoed, en el Real Colegio Agrícola, en 1873. En su nuevo puesto, Kjeldahl pronto se interesó por el contenido de proteínas de los granos utilizados en la industria cervecera – mediciones que en esencia significaban averiguar cuánto nitrógeno contenían sus muestras.
A mediados del siglo XIX, si se quería determinar la relación C:H:N de un compuesto orgánico, entonces el análisis de combustión era el único juego en la ciudad. Gay-Lussac y Liebig habían perfeccionado este arte para determinar el contenido de carbono e hidrógeno, midiendo el dióxido de carbono y el agua producidos cuando un compuesto se quemaba con óxido de cobre.
El nitrógeno, sin embargo, era un cliente más complicado: la combustión incompleta producía óxidos de nitrógeno, y la contaminación por aire siempre era una preocupación. El gran rival analítico de Liebig, Dumas, purgó todo su aparato con dióxido de carbono antes de quemar la muestra, y recogió burbujas de nitrógeno sobre el mercurio. El método era complicado y laborioso.
En lugar de recolectar gas de nitrógeno, los químicos analíticos posteriores prefirieron determinar el contenido de nitrógeno convirtiéndolo cuantitativamente en amoníaco. En 1841 dos de los estudiantes de Liebig, Will y Varrentrapp, desarrollaron un método en el que el compuesto orgánico se pirolizaba directamente con un álcali, liberando amoníaco que se convertía en iones de amonio, se precipitaba en forma de sal y se pesaba.
El método de Kjeldahl
Cuando Kjeldahl comenzó a trabajar en las proteínas de la cebada, este método aún se estaba desarrollando con fuerza, pero era completamente inadecuado para su proyecto, que requería muchos análisis en serie. Kjeldahl necesitaba un método que evitara completamente la combustión.
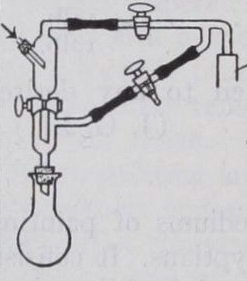
Al digerir sus muestras en ácido sulfúrico concentrado en presencia de permanganato, descubrió que podía generar iones de amonio cuantitativamente. La solución fue entonces diluida y transferida a un simple aparato de destilación que incluía el matraz de cuello largo que vino a llevar su nombre. Al añadir el álcali se liberó el amoníaco, que se destiló directamente de un condensador en ácido estándar. Una serie de aditivos y catalizadores mejoraron el proceso, que hoy en día está mayormente automatizado.
Presentando el método de Kjeldahl al mundo
Kjeldahl incluyó su método en el informe anual de Carlsberg de 1882-83 y lo presentó a la Fundación Química Danesa en marzo de 1883. William Crookes lo reportó con entusiasmo en su Chemical News en agosto y el método se puso de moda rápidamente. En el Journal of Analytical Chemistry el analista L F Kebler comentó que «ningún método ha sido adoptado tan universalmente, en tan poco tiempo, como el método de Kjeldahl».
El mismo Kjeldahl siguió trabajando en su laboratorio perfeccionando otras técnicas y supervisando el diseño de un nuevo laboratorio. Nunca se casó, y murió de una hemorragia cerebral mientras nadaba en el mar en 1900.
El hecho de que fuera sucedido en el laboratorio de Carlsberg por S P L Sorensen, quien inventó la escala de pH, hace que uno se pregunte dónde estaría la humanidad si más cervecerías tomaran una visión tan iluminada de sus beneficios.
En la década de 1960, con el advenimiento de la cromatografía de gases, el método de combustión de Dumas para recoger el gas nitrógeno volvió con fuerza. Pero Carlsberg podía decir con orgullo que por casi un siglo Kjeldahl había sido el mejor método analítico del mundo.
Para más información Classic Kit: Kjeldahl flask
Como citar este artículo:
APA: (2019-06-10). Balón de Kjeldahl. Recuperado de https://quimicafacil.net/infografias/material-de-laboratorio/balon-de-kjeldahl/
ACS: . Balón de Kjeldahl. https://quimicafacil.net/infografias/material-de-laboratorio/balon-de-kjeldahl/. Fecha de consulta 2025-10-23.
IEEE: , "Balón de Kjeldahl," https://quimicafacil.net/infografias/material-de-laboratorio/balon-de-kjeldahl/, fecha de consulta 2025-10-23.
Vancouver: . Balón de Kjeldahl. [Internet]. 2019-06-10 [citado 2025-10-23]. Disponible en: https://quimicafacil.net/infografias/material-de-laboratorio/balon-de-kjeldahl/.
MLA: . "Balón de Kjeldahl." https://quimicafacil.net/infografias/material-de-laboratorio/balon-de-kjeldahl/. 2019-06-10. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net