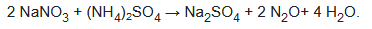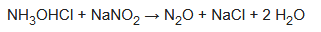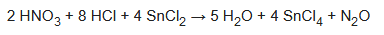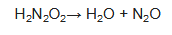Tiempo de lectura estimado: 15 minutos
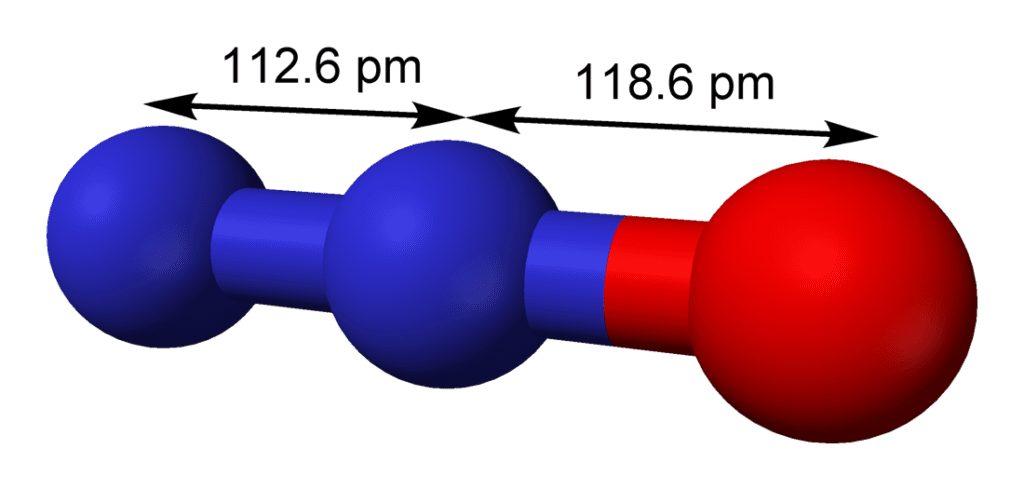
El óxido de nitrógeno (I), también llamado óxido nitroso o gas hilarante, es un compuesto químico, un óxido de nitrógeno con la fórmula N2O. A temperatura ambiente, es un gas incoloro no inflamable, con un ligero olor y sabor metálico. A temperaturas elevadas, el óxido nitroso es un poderoso oxidante similar al oxígeno molecular. Es soluble en agua.
El óxido nitroso tiene importantes usos médicos, especialmente en cirugía y odontología, por sus efectos anestésicos y de reducción del dolor. Su nombre coloquial «gas de la risa», acuñado por Humphry Davy, se debe a los efectos eufóricos al inhalarlo, propiedad que ha llevado a su uso recreativo como anestésico disociativo. También se utiliza como oxidante en los propulsores de cohetes, y en las carreras automovilísticas para aumentar la potencia de los motores.
El óxido nitroso se encuentra en pequeñas cantidades en la atmósfera, pero se ha descubierto que es un importante depurador del ozono estratosférico, con un impacto comparable al de los CFC. Se estima que el 30% del N2O en la atmósfera es el resultado de la actividad humana, principalmente la agricultura y la industria. Siendo el tercer gas de efecto invernadero de larga duración más importante, el óxido nitroso contribuye sustancialmente al calentamiento global.
Historia
El gas fue sintetizado por primera vez en 1772 por el filósofo natural y químico inglés Joseph Priestley, quien lo llamó aire nitroso flogisado o aire nitroso inflamable. Priestley publicó su descubrimiento en el libro Experimentos y observaciones sobre diferentes tipos de aire (1775), donde describió cómo producir la preparación de «aire nitroso disminuido», calentando limaduras de hierro humedecidas con ácido nítrico.
Primeros usos
El primer uso importante del óxido nitroso fue posible gracias a Thomas Beddoes y James Watt, que colaboraron en la publicación del libro Consideraciones sobre el uso médico y la producción de aires ficticios (1794). Este libro fue importante por dos razones. En primer lugar, James Watt había inventado una novedosa máquina para producir «Aires ficticios» (es decir, óxido nitroso) y un novedoso «aparato de respiración» para inhalar el gas. En segundo lugar, el libro también presentaba las nuevas teorías médicas de Thomas Beddoes, que la tuberculosis y otras enfermedades pulmonares podían ser tratadas por la inhalación de «Aires ficticios».
La máquina para producir «Aires ficticios» tenía tres partes: un horno para quemar el material necesario, un recipiente con agua por donde pasaba el gas producido en un tubo en espiral (para que las impurezas se «lavaran») y, por último, el cilindro de gas con un gasómetro en el que el gas producido, «aire», podía ser introducido en bolsas de aire portátiles (hechas de seda oleosa herméticas).

El aparato de respiración consistía en una de las bolsas de aire portátiles conectada con un tubo a una boquilla. Con este nuevo equipo siendo diseñado y producido para 1794, se preparó el camino para los ensayos clínicos, que comenzaron en 1798 cuando Thomas Beddoes estableció la «Institución Neumática para el Alivio de Enfermedades por Aires Médicos» en Hotwells (Bristol). En el sótano del edificio, una máquina a gran escala producía los gases bajo la supervisión de un joven Humphry Davy, a quien se le animó a experimentar con nuevos gases para que los pacientes los inhalaran: En Researches, Chemical and Philosophical (1800). En esa publicación, Davy señala el efecto analgésico del óxido nitroso en la página 465 y su potencial para ser usado en operaciones quirúrgicas en la página 556. Davy acuñó el nombre «gas de la risa» para el óxido nitroso.
A pesar del descubrimiento de Davy de que la inhalación de óxido nitroso podía aliviar el dolor de una persona consciente, pasaron otros 44 años antes de que los médicos intentaran utilizarlo para la anestesia. El uso del óxido nitroso como droga recreativa en las «fiestas del gas hilarante», organizadas principalmente para la clase alta británica, se convirtió en un éxito inmediato a partir de 1799. Si bien los efectos del gas generalmente hacen que el usuario parezca estupefacto, soñador y sedado, algunas personas también «se ríen» en un estado de euforia, y frecuentemente estallan en risa.
Uno de los primeros productores comerciales de los EE.UU. fue George Poe, primo del poeta Edgar Allan Poe, que también fue el primero en licuar el gas.
Uso como anestesia
La primera vez que se utilizó el óxido de nitrógeno (I) como fármaco anestésico en el tratamiento de un paciente fue cuando el dentista Horace Wells, con la ayuda de Gardner Quincy Colton y John Mankey Riggs, demostró insensibilidad al dolor por una extracción dental el 11 de diciembre de 1844.
En las semanas siguientes, Wells trató a los primeros 12 a 15 pacientes con óxido nitroso en Hartford, Connecticut, y, según su propio historial, sólo fracasó en dos casos. A pesar de que estos convincentes resultados fueron comunicados por Wells a la sociedad médica de Boston en diciembre de 1844, este nuevo método no fue adoptado inmediatamente por otros dentistas. La razón de ello fue muy probablemente que Wells, en enero de 1845, en su primera demostración pública a la facultad de medicina de Boston, había sido en parte infructuosa, lo que dejó a sus colegas con dudas sobre su eficacia y seguridad.
El método no llegó a ser de uso general hasta 1863, cuando Gardner Quincy Colton comenzó a utilizarlo con éxito en todas sus clínicas de la «Asociación Dental Colton», que acababa de establecer en New Haven y en la ciudad de Nueva York. Durante los tres años siguientes, Colton y sus asociados administraron con éxito óxido nitroso a más de 25.000 pacientes. Hoy en día, el óxido nitroso se utiliza en odontología como ansiolítico, como complemento de la anestesia local.
Sin embargo, se comprobó que el óxido de nitrógeno (I) no era un anestésico suficientemente fuerte para su uso en cirugías importantes en entornos hospitalarios. En cambio, el éter dietílico, por ser un anestésico más fuerte y potente, se demostró y aceptó para su uso en octubre de 1846, junto con el cloroformo en 1847.
Sin embargo, cuando Joseph Thomas Clover inventó el «inhalador de éter gaseoso» en 1876, se convirtió en una práctica común en los hospitales para iniciar todos los tratamientos anestésicos con un flujo leve de óxido nitroso, y luego aumentar gradualmente la anestesia con el éter más fuerte o el cloroformo. El inhalador de gas-éter de Clover se diseñó para suministrar al paciente óxido nitroso y éter al mismo tiempo, siendo el operador del dispositivo quien controla la mezcla exacta. Muchos hospitales lo siguieron utilizando hasta el decenio de 1930. Aunque hoy en día los hospitales utilizan una máquina de anestesia más avanzada, estas máquinas siguen utilizando el mismo principio lanzado con el inhalador de gas-éter de Clover, para iniciar la anestesia con óxido nitroso, antes de la administración de un anestésico más potente.
Uso del óxido de nitrógeno (I) como una medicina patentada
La popularización del óxido nitroso por parte de Colton llevó a su adopción por un número de curanderos de menor reputación, que lo promocionaron como una cura para el consumo, escrófula, catarro y otras enfermedades de la sangre, garganta y pulmones. El tratamiento con óxido nitroso fue administrado y autorizado como medicina patentada por personas como C. L. Blood y Jerome Harris en Boston y Charles E. Barney de Chicago.
Síntesis del óxido de nitrógeno (I)
Escala industrial
El óxido nitroso se prepara a escala industrial mediante un cuidadoso calentamiento del nitrato de amonio a unos 250 C, que se descompone en óxido nitroso y vapor de agua.
La adición de diversas sales de fosfato favorece la formación de un gas más puro a temperaturas ligeramente más bajas. Esta reacción puede ser difícil de controlar, dando lugar a detonación.
Laboratorio
La descomposición del nitrato de amonio es también un método de laboratorio común para preparar el gas. Equivalentemente, se puede obtener calentando una mezcla de nitrato de sodio y sulfato de amonio:
Otro método consiste en la reacción de la urea, el ácido nítrico y el ácido sulfúrico:
Se ha informado de la oxidación directa del amoníaco con un catalizador de dióxido de manganeso y óxido de bismuto: A esta reacción se le llama proceso de Ostwald.
El cloruro de hidroxilamonio reacciona con el nitrito de sodio para dar óxido nitroso. Si se añade el nitrito a la solución de hidroxilamina, el único subproducto que queda es el agua salada. Sin embargo, si se añade la solución de hidroxilamina a la solución de nitrito (el nitrito está en exceso), también se forman óxidos de nitrógeno más altos y tóxicos:
También se ha demostrado el tratamiento del HNO3 con SnCl2 y HCl:
El ácido hiponitroso se descompone en N2O y agua con una vida media de 16 días a 25 °C a pH 1-3.
Usos
En medicina, el óxido de nitrógeno (I) se utiliza como gas analgésico (contra el dolor) con fines anestésicos o en una combinación fija de 50 % de óxido nitroso y 50 % de oxígeno (MEOPA) para el tratamiento del dolor en procedimientos quirúrgicos cortos y moderadamente dolorosos. También se utiliza ampliamente como sedante de óxido nitroso titulable en odontología.
Es un anestésico que se ha utilizado regularmente desde 1844 y tiene relativamente pocos efectos secundarios. El uso de N2O puede provocar una alteración del efecto de la vitamina B12 y el ácido fólico y, por lo tanto, las consecuencias de la anemia perniciosa. También existe el riesgo de que se produzcan efectos indeseables en el sistema cardiovascular cuando se utiliza en pacientes con una disfunción muscular cardíaca grave. Además, el óxido nitroso puede aumentar la resistencia vascular pulmonar.
Para lograr una concentración efectiva del 70%, debe administrarse (como lo reconoció por primera vez Andrews en 1868) junto con oxígeno puro. Se considera un anestésico relativamente débil y se utiliza principalmente de manera de apoyo. En la anestesia moderna, el efecto del óxido nitroso se complementa con la adición de otros agentes anestésicos. La ventaja del óxido nitroso es que el gas entra y sale rápidamente (bajo coeficiente de distribución de sangre/gas), lo que hace que la anestesia sea fácilmente controlable y que la depresión respiratoria sea escasa o nula.
El gas se excreta principalmente a través de los pulmones, y una pequeña cantidad se difunde a través de la piel. La difusión del óxido de nitrógeno (I) en cavidades corporales llenas de aire puede ser problemática; esto puede llevar a la hipoxia de difusión en los pulmones. En este caso el óxido nitroso desplaza el oxígeno de los alvéolos. Esto puede evitarse mediante la inhalación de oxígeno.
El uso médico del óxido nitroso como anestésico ha ido disminuyendo durante mucho tiempo. Se recomienda para la autoadministración en caso de dolor leve y moderado. Por ejemplo, ahora se está volviendo a utilizar en obstetricia para reducir el dolor de parto, entre otros usos. Además, el óxido nitroso se utiliza en la crioablación como refrigerante líquido (óxido nítrico, gas hilarante) y se introduce en el catéter del crioglobo. Allí se evapora y extrae el calor del tejido circundante. La formación de hielo destruye las células del músculo cardíaco afectadas.
En odontología, el óxido nitroso ha sido un agente probado y comprobado durante decenios, y se utiliza sobre todo para los niños y los pacientes ansiosos, pero también en casos de reflejo nauseoso grave. Los efectos secundarios son raros cuando se administran correctamente.
En la tecnología alimentaria, el óxido nitroso se utiliza como aditivo alimentario aprobado (E 942) debido a su buena solubilidad en grasa bajo presión como gas propulsor, preferentemente para productos lácteos, por ejemplo, para espumar (en lugar de batir) la nata o crema batida.
En el escenario de las drogas, el óxido nitroso se utiliza por su efecto disociativo y su fácil disponibilidad. La intoxicación dura de 30 segundos a 3 minutos. Hay efectos disociativos, fuertes cambios en la percepción del sonido (eco, distorsión), hormigueo en las extremidades, relajación de los músculos y una fuerte sensación de bienestar, a veces también euforia. Con el consumo frecuente existe el riesgo de deficiencia de vitamina B12. Repetidamente, también se han producido muertes con este uso.
En la tecnología de propulsión, por ejemplo, en los automóviles de pasajeros, el óxido de nitrógeno (I) se utiliza para aumentar la potencia de los motores de gasolina, ya que contiene más oxígeno que el aire. Esta llamada inyección de óxido nitroso sólo requiere cambios de diseño relativamente menores en el motor y puede aumentar su potencia entre un 20 y un 50% a corto plazo. El óxido nitroso es inyectado en el dispositivo de entrada desde los tanques de presión. Esta puesta a punto está especialmente extendida en los Estados Unidos, pero su uso en el tráfico de carreteras públicas está prohibido tanto allí como en Alemania (con la excepción de un sistema con ABE) y la mayoría de los demás países sólo lo permiten de forma limitada. Los fabricantes más conocidos de inyecciones de óxido nitroso son NOS, NX y Venom, así como ZEX.
La técnica fue utilizada durante la Segunda Guerra Mundial por los aviones de la Luftwaffe con el sistema GM-1 para aumentar la potencia de los motores de los aviones. Originalmente destinado a proporcionar a los aviones estándar de la Luftwaffe un rendimiento superior a gran altitud, las consideraciones tecnológicas limitaron su uso a altitudes extremadamente altas. Por consiguiente, sólo fue utilizado por aviones especializados como aviones de reconocimiento a gran altitud, bombarderos de alta velocidad y aviones interceptores de gran altitud. A veces se podía encontrar en aviones de la Luftwaffe que también estaban equipados con otro sistema de propulsión de motores, el MW 50, una forma de inyección de agua para los motores de aviación que utilizaba metanol para sus capacidades de propulsión.
En la cohetería, el óxido nitroso se utiliza como oxidante, por ejemplo, en cohetes híbridos como el SpaceShipOne. La ventaja es que se puede licuar por presión sin necesidad de refrigeración. Por lo tanto, sólo se necesita una válvula de mariposa para su uso en tales motores, pero no una bomba de combustible o criogenia compleja.
En la espectrometría de absorción atómica (AAS), la llama AAS utiliza óxido nitroso en lugar de aire en una llama de acetileno para generar temperaturas más altas (2800 °C).
En la investigación de la catálisis, el óxido nitroso se utiliza en la cromatografía frontal reactiva para determinar la superficie de cobre catalíticamente efectiva.
Para más información Nitrous oxide | N2O – PubChem
Como citar este artículo:
APA: (2021-06-22). Óxido de nitrógeno (I). Recuperado de https://quimicafacil.net/compuesto-de-la-semana/oxido-de-nitrogeno-i/
ACS: . Óxido de nitrógeno (I). https://quimicafacil.net/compuesto-de-la-semana/oxido-de-nitrogeno-i/. Fecha de consulta 2025-07-02.
IEEE: , "Óxido de nitrógeno (I)," https://quimicafacil.net/compuesto-de-la-semana/oxido-de-nitrogeno-i/, fecha de consulta 2025-07-02.
Vancouver: . Óxido de nitrógeno (I). [Internet]. 2021-06-22 [citado 2025-07-02]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/oxido-de-nitrogeno-i/.
MLA: . "Óxido de nitrógeno (I)." https://quimicafacil.net/compuesto-de-la-semana/oxido-de-nitrogeno-i/. 2021-06-22. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net