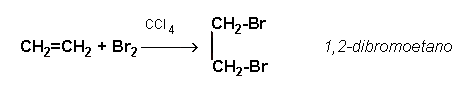Tiempo de lectura estimado: 6 minutos
En química, un alqueno es un hidrocarburo que contiene un doble enlace carbono-carbono. Sin embargo, la IUPAC recomienda utilizar el nombre «alqueno» sólo para los hidrocarburos acíclicos con un solo doble enlace; alcadieno, alcatrieno, etc., o polieno para los hidrocarburos acíclicos con dos o más dobles enlaces; cicloalqueno, cicloalquadieno, etc., para los cíclicos; y «olefina» para la clase general, cíclica o acíclica, con uno o más dobles enlaces.
Los alquenos acíclicos, con un solo doble enlace y sin otros grupos funcionales (también conocidos como mono-enos) forman una serie homóloga de hidrocarburos con la fórmula general CnH2n siendo n 2 o más (que es dos hidrógenos menos que el alcano correspondiente). Cuando n es cuatro o más, existen múltiples isómeros con esta fórmula, que se distinguen por la posición y la conformación del doble enlace.
Propiedades de los alquenos
Los alquenos son compuestos apolares generalmente incoloros, algo similares a los alcanos, pero más reactivos. Los primeros miembros de la serie son gases o líquidos a temperatura ambiente. El alqueno más simple, el etileno (C2H4) (o «eteno» en la nomenclatura de la IUPAC) es el compuesto orgánico que se produce a mayor escala industrialmente.
Los compuestos aromáticos se dibujan a menudo como alquenos cíclicos, pero su estructura y propiedades son lo suficientemente distintas como para no clasificarlos como alquenos u olefinas Los hidrocarburos con dos dobles enlaces superpuestos (C=C=C) se denominan alenos -el compuesto más simple de este tipo se llama a su vez aleno- y los que tienen tres o más enlaces superpuestos (C=C=C, C=C=C=C, etc.) se denominan cumulenos. Algunos autores no consideran que los alenos y los cumulenos sean «alquenos».
Los alquenos son compuestos en los que el carbono está hibridado sp2. Cada orbital forma ángulos de 120° con los vecinos. Entre dos átomos de carbono existe un doble enlace formado por un enlace de tipo s y por una nube electrónica perpendicular a él que corresponde al enlace p; éste está, por tanto, formado por el orbital p no hibridado que se solapa con otro orbital p no hibridado del átomo de carbono cercano. La fórmula general es CnH2n. Tienen un comportamiento apolar. Los alquenos de C2 a C4 son gaseosos, los líquidos de C5 a C16 y los sólidos de C17 en adelante.
Las reacciones de los alquenos generalmente implican la ruptura del enlace mediante la adición de iones o radicales. Son posibles las reacciones de oxidación con oxidantes fuertes.
En estos apuntes se discuten en general las reacciones que se pueden realizar fácilmente en el laboratorio, es decir, las reacciones de oxidación con glicoles y la adición de halógenos.
Oxidación a glicoles:
Algunos oxidantes energéticos, por ejemplo, el permanganato potásico, en ambiente alcalino y frío, transforman los alquenos en glicoles (o dioles), alcoholes con dos grupos -OH. La reacción, referida al etileno, es la siguiente:
Adición de halógenos:
Los alquenos reaccionan fácilmente con el bromo y el cloro transformándose en compuestos saturados que contienen 2 átomos de halógeno unidos a átomos de carbono adyacentes. Estos compuestos se denominan haluros de alquilo. La reacción se produce al mezclar el alqueno y el halógeno en una solución de tetracloruro de carbono. La reacción, referida al etileno, es la siguiente:
Materiales
- Tubos de ensayo
- Pinza para tubos de ensayo
- Mechero Bunsen
- Pipetas graduadas de 10 mL
- Propipeta o pipeteador
Reactivos
- 1-octeno
- Hexano
- Tetracloruro de carbono
- Permanganato de potasio sol. 0,001 M
- Hidróxido de sodio sol. 1 M
- Agua de bromo saturada
- Parafina
- Cloruro de sodio
- Etano
- Yodo resublimado
Procedimiento
Primera parte: oxidación a glicol del 1-octeno
En un tubo de ensayo colocar 3 o 4 mL de permanganato potásico sol. 0,001 M y alcalinizar con 2 o 3 gotas de hidróxido de sodio sol, 1 M; Por último, añadir 1 mL de 1-octeno y agitar.
En resumen, se observa la desaparición del color violeta, con la aparición de un tenue color marrón; esto indica la reducción de Mn7+ a Mn4+ con la oxidación simultánea del 1-octeno a octilenglicol (1,2-octanediol) por la reacción:
Nota: La aparición de una coloración verdosa indica que no se ha producido una reducción completa de Mn7+ a Mn4+, sino una reducción parcial a Mn6+. Esto puede deberse a una concentración molar demasiado alta de KMnO4 o a una basicidad demasiado elevada. Esta última situación provoca, de hecho, una estabilización del Mn6+.
Para remediar lo anterior, es aconsejable repetir el experimento con una solución de permanganato más diluida y con menor alcalinización. Al límite, un ligero calentamiento con el bunsen puede ayudar a la reacción.
Segunda parte: adición de bromo al 1-octeno
Poner 4 ó 5 mL de agua saturada de bromo en un tubo de ensayo y añadir aproximadamente 1 mL de 1-octeno, agitando la mezcla. En definitiva, se observa una decoloración del agua de bromo, lo que indica que el propio bromo se ha unido al alqueno, rompiendo el doble enlace y formando un haluro de alquilo:
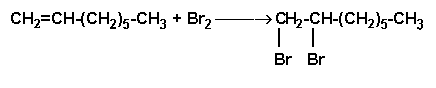
Tercera parte: Pruebas comparativas de miscibilidad y solubilidad de alquenos
Los alquenos tienen un comportamiento apolar. Es posible verificar este comportamiento mediante pruebas de miscibilidad con otros hidrocarburos o derivados (hexano, benceno, tetracloruro de carbono, cloroformo) y con disolventes derivados (por ejemplo, hexano, benceno, tetracloruro de carbono, cloroformo) y con disolventes polares (por ejemplo, agua o etanol).
Las pruebas de solubilidad del alqueno pueden realizarse, por ejemplo, con un alcano sólido (parafina) y con sustancias moleculares (por ejemplo, yodo, sacarosa) o iónicas (por ejemplo, cloruro de sodio).
Los resultados de las pruebas anteriores pueden recogerse en un cuadro sinóptico especialmente preparado.
Después del laboratorio
Elaborar una tabla con los resultados de miscibilidad y solubilidad de alquenos con las sustancias estudiadas. Explicar el porque la diferencia de comportamiento entre las sustancias moleculares y iónicas.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información MAKING ALKENES IN THE LAB
Como citar este artículo:
APA: (2021-11-24). Química de los alquenos. Recuperado de https://quimicafacil.net/manual-de-laboratorio/quimica-de-los-alquenos/
ACS: . Química de los alquenos. https://quimicafacil.net/manual-de-laboratorio/quimica-de-los-alquenos/. Fecha de consulta 2024-07-27.
IEEE: , "Química de los alquenos," https://quimicafacil.net/manual-de-laboratorio/quimica-de-los-alquenos/, fecha de consulta 2024-07-27.
Vancouver: . Química de los alquenos. [Internet]. 2021-11-24 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/quimica-de-los-alquenos/.
MLA: . "Química de los alquenos." https://quimicafacil.net/manual-de-laboratorio/quimica-de-los-alquenos/. 2021-11-24. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net