Actualizado en mayo 22, 2023
Tiempo de lectura estimado: 6 minutos
El etileno (nombre IUPAC: eteno) es un hidrocarburo que tiene la fórmula C2H4 o H2C=CH2. Es un gas incoloro e inflamable con un ligero olor «dulce y almizclado» cuando está puro. Es el alqueno más simple (un hidrocarburo con dobles enlaces carbono-carbono).
El etileno se utiliza ampliamente en la industria química, y su producción mundial (más de 150 millones de toneladas en 2016) supera a la de cualquier otro compuesto orgánico. Gran parte de esta producción se destina al polietileno, un plástico muy utilizado que contiene cadenas poliméricas de unidades de etileno en varias longitudes de cadena. Es también una importante hormona natural de las plantas y se utiliza en la agricultura para forzar la maduración de las frutas.
Historia del etileno
Algunos geólogos y estudiosos creen que el famoso oráculo griego de Delfos (la Pitia) entraba en su estado de trance como efecto del etileno que subía de las fallas del suelo.
El etileno parece haber sido descubierto por Johann Joachim Becher, que lo obtuvo calentando etanol con ácido sulfúrico; mencionó el gas en su Physica Subterranea (1669). Joseph Priestley también menciona el gas en su Experiments and observations relating to the various branches of natural philosophy: with a continuation of the observations on air (1779), donde informa de que Jan Ingenhousz vio sintetizar el etileno de la misma manera por un Sr. Enée en Ámsterdam en 1777 y que posteriormente Ingenhousz produjo el gas él mismo.
Sus propiedades fueron estudiadas en 1795 por cuatro químicos holandeses, Johann Rudolph Deimann, Adrien Paets van Troostwyck, Anthoni Lauwerenburgh y Nicolas Bondt, que descubrieron que se diferenciaba del gas hidrógeno y que contenía tanto carbono como hidrógeno.
A mediados del siglo XIX, el sufijo -ene (una raíz griega antigua que se añadía al final de los nombres femeninos y que significaba «hija de») se utilizaba ampliamente para referirse a una molécula o parte de ella que contenía un átomo de hidrógeno menos que la molécula que se modificaba. Así, el etileno (C2H4) era la «hija del etilo» (C2H5). El nombre de etileno se utilizó en este sentido ya en 1852.
Etileno y la nomenclatura
En 1866, el químico alemán August Wilhelm von Hofmann propuso un sistema de nomenclatura de hidrocarburos en el que se utilizaban los sufijos -ane, -ene, -ine, -one y -une para designar los hidrocarburos con 0, 2, 4, 6 y 8 hidrógenos menos que su alcano de origen.
El sistema de Hofmann acabó convirtiéndose en la base de la nomenclatura de Ginebra aprobada por el Congreso Internacional de Químicos en 1892, que sigue siendo el núcleo de la nomenclatura de la IUPAC. Sin embargo, para entonces, el nombre de etileno estaba muy arraigado y sigue siendo muy utilizado hoy en día, especialmente en la industria química.
Tras los experimentos realizados por Luckhardt, Crocker y Carter en la Universidad de Chicago, el etileno se utilizó como anestésico y se mantuvo en uso hasta la década de 1940, incluso cuando el cloroformo estaba siendo eliminado. Su olor penetrante y su naturaleza explosiva limitan su uso en la actualidad.
Las reglas de nomenclatura de la IUPAC de 1979 hicieron una excepción para mantener el nombre no sistemático de etileno; sin embargo, esta decisión fue revocada en las reglas de 1993, y permanece sin cambios en las recomendaciones más recientes de 2013, por lo que el nombre de la IUPAC es ahora eteno.
Nótese que, en el sistema de la IUPAC, el nombre etileno está reservado para el grupo divalente -CH2CH2-. Por lo tanto, se permiten nombres como óxido de etileno y dibromuro de etileno, pero no se permite el uso del nombre etileno para el alqueno de dos carbonos. No obstante, el uso del nombre etileno para H2C=CH2 (y propileno para H2C=CHCH3) sigue siendo frecuente entre los químicos de Norteamérica.
Estructura y propiedades
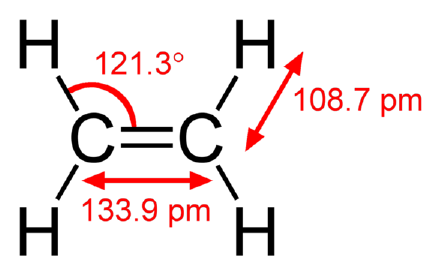
Este hidrocarburo tiene cuatro átomos de hidrógeno unidos a un par de átomos de carbono que están conectados por un doble enlace. Los seis átomos que componen el etileno son coplanares. El ángulo H-C-H es de 117,4°, cercano a los 120° del carbono hibridado sp² ideal. La molécula es también relativamente débil: la rotación sobre el enlace C-C es un proceso de muy baja energía que requiere romper el enlace π suministrando calor a 50°C.
El enlace π de la molécula de etileno es el responsable de su útil reactividad. El doble enlace es una región de alta densidad de electrones, por lo que es susceptible de ser atacado por electrófilos. Muchas reacciones del etileno son catalizadas por metales de transición, que se unen transitoriamente al etileno utilizando los orbitales π y π*.
Al ser una molécula simple es espectroscópicamente sencillo. Su espectro UV-vis se sigue utilizando como prueba de métodos teóricos.
Usos del etileno
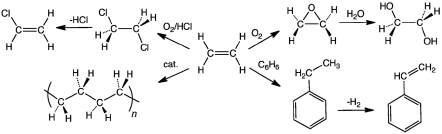
Las principales reacciones industriales del etileno son, por orden de importancia 1) polimerización, 2) oxidación, 3) halogenación e hidrohalogenación, 4) alquilación, 5) hidratación, 6) oligomerización y 7) hidroformilación. En Estados Unidos y Europa, aproximadamente el 90% del etileno se utiliza para producir óxido de etileno, dicloruro de etileno, etilbenceno y polietileno. La mayoría de las reacciones con el etileno son de adición electrofílica.
Para más información Ethylene: The “World’s Most Important Chemical”
Como citar este artículo:
APA: (2022-06-28). Etileno. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/etileno/
ACS: . Etileno. https://quimicafacil.net/compuesto-de-la-semana/etileno/. Fecha de consulta 2024-07-27.
IEEE: , "Etileno," https://quimicafacil.net/compuesto-de-la-semana/etileno/, fecha de consulta 2024-07-27.
Vancouver: . Etileno. [Internet]. 2022-06-28 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/etileno/.
MLA: . "Etileno." https://quimicafacil.net/compuesto-de-la-semana/etileno/. 2022-06-28. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net