Tiempo de lectura estimado: 5 minutos
Historia
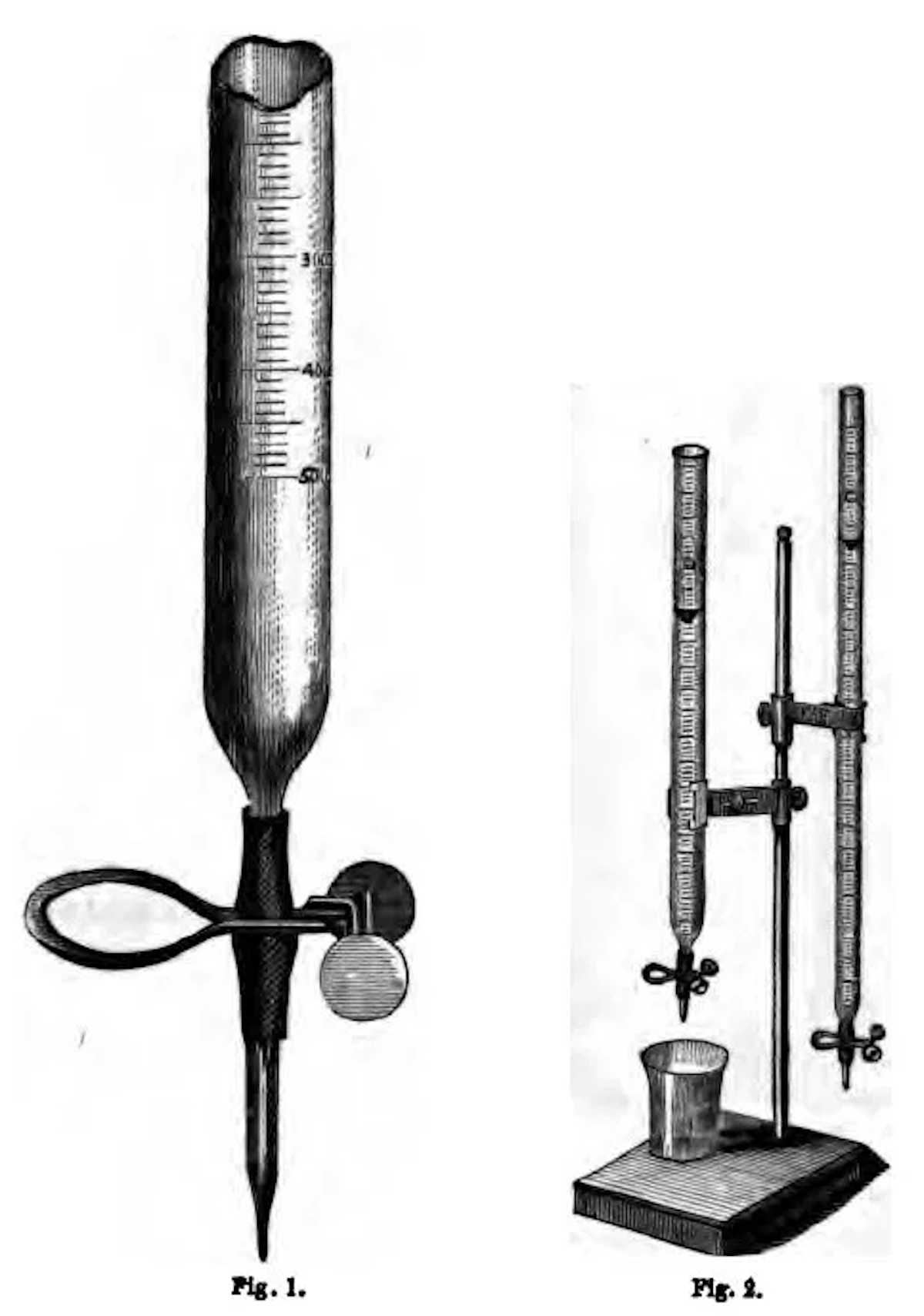
El kaliapparat es uno de los primeros instrumentos de laboratorio dedicado al análisis químico orgánico. Esta cristalería de moda con forma de triángulo no es una decoración de oficina, sino un verdadero vestigio de la química analítica temprana. Se llama kaliapparat, un dispositivo tubular de vidrio hueco utilizado para medir el contenido de carbono de las sustancias en 1830 por el químico alemán Justus Liebig, considerado el padre de la química orgánica.
Después de su aparición, por ser tan fiable, se extendió por los laboratorios de Europa y el norte de África en cuestión de años. Miren este dispositivo de nuevo. ¿Le resulta familiar? No es otro que el logotipo de la Sociedad Química Americana, el mismo que se sigue usando hoy en día más de un siglo después.
Como tal, el kaliapparat es uno de los aparatos químicos y herramientas analíticas más importantes de la historia. También es uno de los más oscuros. Pocos químicos lo conocen. La mayoría de los miembros de la ACS no tienen ni idea de lo que es o de lo que significa el logo.
Fundamento del Kaliapparat
El principio de funcionamiento del kaliapparat es muy simple. Dentro de una cristalería separada se quema una sustancia, y los vapores que transportan los productos de la combustión se dirigen a través del kaliapparat. Primero, los productos pasan a través del cloruro de calcio que absorbe el vapor de agua. Luego, el tren de combustión, desprovisto de agua, pasa por el kaliapparat mismo donde se coloca una solución de hidróxido de potasio. El hidróxido de potasio absorbe el dióxido de carbono quemado de la sustancia.
El hidróxido de potasio se mantiene dentro de los tres bulbos inferiores. Si hay burbujas violentas dentro de los bulbos, significa que el proceso de absorción de CO2 aún tiene lugar. En el tercer bulbo, debería haber poca o ninguna absorción. Simplemente «a ojo», tienes un gran panorama de cómo está funcionando tu experimento.

Cuando la operación termina y el producto se quema completamente, un químico simplemente tiene que pesar la muestra de hidróxido. Al restar la masa de post y pre-combustión, se obtiene la masa del CO2. Como conocemos la masa de oxígeno, podemos saber cuánto carbono pesa una muestra.
Evolución del análisis químico
Hoy en día, las muestras también se queman para determinar su contenido de carbono, pero los instrumentos son mucho más sofisticados. El oxígeno puro se quema con la muestra, luego los productos se aceleran, pasan a través de filtros y se leen con precisión atómica por escáneres infrarrojos y espectrómetros. Sin embargo, el kaliapparat sigue siendo competitivo, y excelente para las estimaciones. Lo que le falta en sofisticación, lo compensa en innovación.
En 2005, Alan Rocke, un historiador de la química de la Universidad Case Western Reserve, hizo un estudio en el que puso los experimentos del kaliapparat de Liebig a prueba. «Algunos historiadores pensaron que la mitología del kaliapparat estaba exagerada», dice Rocke, «y había más que un poco de incertidumbre sobre lo que el dispositivo podía hacer en realidad».
Probaron el kaliapparat con ácido tartárico, urea, cinchonina y narcotina, y encontraron que el método analítico era notablemente preciso. «Es alucinante que un simple aparato pueda dar la calidad de los análisis modernos.» Por supuesto, también hubo algunos percances.
El kaliapparat demostró ser poco fiable para el nitrógeno. Tampoco puede analizar alcaloides complejos como la morfina o la quinina. Liebig sabía esto y eventualmente instruyó a sus estudiantes para introducir la síntesis como un método para investigar la química orgánica. Se puede decir que, inspirado por el kaliapparat, o sus limitaciones para ser más precisos, nació la química orgánica sintética.
«La imagen de un químico, con una bata de laboratorio, frente a un aparato de vidrio burbujeante se remonta al kaliapparat», dice William Brock, profesor emérito de la Universidad de Leicester en Inglaterra y biógrafo de Liebig. «Se convirtió en un símbolo, como la tabla periódica, de lo que hacen los químicos.»
El Kaliapparat de Liebig permaneció en uso durante tres cuartos de siglo y se convirtió en una insignia de honor de la química orgánica. También es una insignia física que aparece en el logo de la Sociedad Química Americana, en la esquina suroeste del Laboratorio de Química Sterling, y como una escultura de madera en la Biblioteca de Química de Yale.
Para más información A Most Important Artifact
Como citar este artículo:
APA: (2018-05-28). Kaliapparat. Recuperado de https://quimicafacil.net/infografias/material-de-laboratorio/kaliapparat/
ACS: . Kaliapparat. https://quimicafacil.net/infografias/material-de-laboratorio/kaliapparat/. Fecha de consulta 2026-01-26.
IEEE: , "Kaliapparat," https://quimicafacil.net/infografias/material-de-laboratorio/kaliapparat/, fecha de consulta 2026-01-26.
Vancouver: . Kaliapparat. [Internet]. 2018-05-28 [citado 2026-01-26]. Disponible en: https://quimicafacil.net/infografias/material-de-laboratorio/kaliapparat/.
MLA: . "Kaliapparat." https://quimicafacil.net/infografias/material-de-laboratorio/kaliapparat/. 2018-05-28. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net