Tiempo de lectura estimado: 7 minutos
La cromatografía de gases es una excelente herramienta analítica para separar mezclas en una muestra. En esta artículo se discuten los detalles de la separación, y se amplía la discusión general de la teoría de separación en cromatografía que se trató aquí
Separación en cromatografía de gases
La columna de cromatografía de gases es la que permite la separación de los componentes de una mezcla por el equipo. Está compuesta por un tubo delgado y hueco de aproximadamente 0,5 mm de grosor, y está revestido con un revestimiento polimérico muy fino de 0,1-5μm de grosor en promedio (Figura 2.80a). Las columnas pueden tener entre 15 y 100 metros de longitud (aunque lo habitual es que tengan 30 metros) y pueden intercambiarse en función de los objetivos del experimentador. Hay columnas diseñadas específicamente para analizar venenos, muestras de biodiésel o compuestos quirales. En la Figura 1 se muestra un ejemplo de columna capilar académica típica, que está revestida con un polímero de «dimetilpolisiloxano».
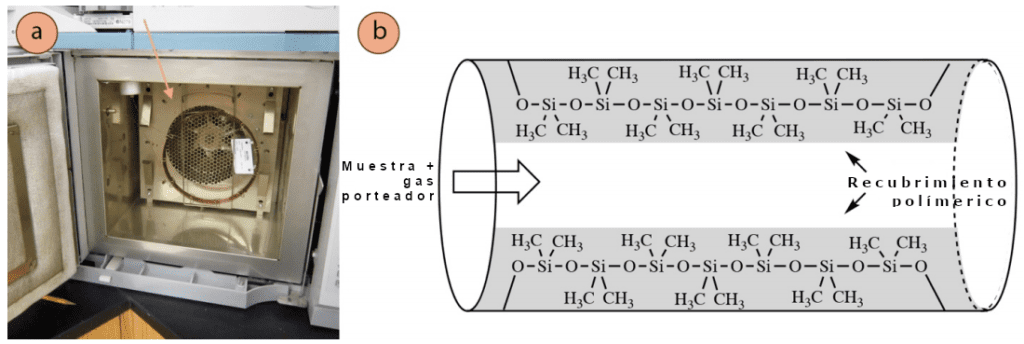
Como en todas las formas de cromatografía, los compuestos se equilibran entre una fase estacionaria y una fase móvil. En cromatografía de gases, la fase estacionaria es el revestimiento interior polimérico de la columna, y los compuestos pueden interactuar con este líquido de alto punto de ebullición a través de varios tipos de fuerzas intermoleculares (FIM). La fase móvil es el gas portador (normalmente helio), que es empujado continuamente a través de la columna.
Las muestras entran en la columna en la fase gaseosa, se adhieren posteriormente al revestimiento de la columna y establecen un equilibrio entre las fases estacionaria y móvil, que se puede modelar con la siguiente ecuación.
Los compuestos pasan a la fase móvil si la energía térmica del horno proporciona la suficiente energía para superar las fuerzas intermoleculares entre el compuesto y el revestimiento de la columna. Cuando están en la fase móvil, los compuestos son barridos con el flujo del gas portador y se vuelven a adherir al revestimiento de la columna más adelante. Se puede pensar que los compuestos rebotan de una posición a otra hasta que salen de la columna.
Como todos los compuestos tienen la misma longitud que recorrer antes de salir de la columna, todos pasan el mismo tiempo en la fase móvil. Por lo tanto, la separación se debe a la cantidad variable de tiempo que pasa en la fase estacionaria, o al tiempo que los compuestos se adhieren al revestimiento de la columna.
Los compuestos que tienen fuerzas intermoleculares débiles con el revestimiento de la columna pasan poco tiempo «colgados» en la fase estacionaria, ya que el calor del horno permite que se rompan sus fuerzas intermoleculares. Salen rápidamente de la columna y, por tanto, tienen un tiempo de retención corto. Por el contrario, los compuestos que pueden formar fuerzas intermoleculares fuertes con el revestimiento de la columna favorecerán la fase estacionaria y tardarán mucho tiempo en salir de la columna (tendrán un tiempo de retención largo).
El tipo de fuerzas intermoleculares experimentado con el revestimiento de la columna suele ser paralelo al tipo de fuerzas intermoleculares experimentado en la fase líquida pura, lo que significa que un compuesto que puede formar enlaces de hidrógeno en su fase líquida (Figura 2a) también puede formar enlaces de hidrógeno con el revestimiento de la columna (Figura 2b). Por lo tanto, la fuerza de la interacción con el revestimiento de la columna se correlaciona estrechamente con el punto de ebullición de un compuesto, y los puntos de ebullición pueden utilizarse para predecir el orden de elución en cromatografía.

En resumen:
- Los compuestos que tienen fuerzas intermoleculares débiles con el revestimiento de la columna (puntos de ebullición bajos), pasan poco tiempo en la fase estacionaria, salen de la columna antes y tienen tiempos de retención más cortos.
- Los compuestos que tienen fuerzas intermoleculares fuertes con el revestimiento de la columna (puntos de ebullición altos), tienen tiempos de retención más largos.
Consideraciones estructurales
Para demostrar el efecto de las consideraciones estructurales, la figura 3 muestra el espectro de cromatografía de una mezcla que contiene heptano, octano, nonano y decano. El orden de elución sigue de cerca la tendencia al aumento del punto de ebullición. El heptano tiene el punto de ebullición más bajo de la serie y sale primero de la columna (tiene el tiempo de retención más corto). A medida que aumenta la longitud de la cadena, también lo hace el punto de ebullición, y los tiempos de retención también aumentan (Tabla 1).


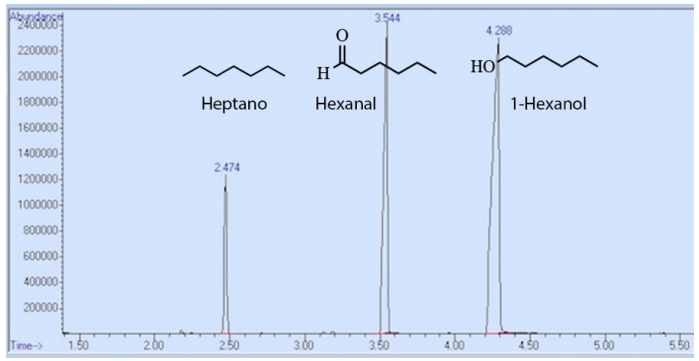
En otro ejemplo, la figura 4 muestra el espectro de cromatografía de una mezcla que contiene heptano, hexanal y 1-hexanol. El orden de elución sigue de nuevo la tendencia del punto de ebullición. El 1-hexanol tiene las fuerzas intermoleculares más fuertes, ya que puede interactuar con la columna tanto a través de las fuerzas de dispersión de London (LDF) como de los enlaces de hidrógeno. Esto hace que se adhiera a la fase estacionaria con más fuerza, lo que da lugar al mayor tiempo de retención. El heptano interactúa con el revestimiento de la columna a través de LDF más débiles, por lo que pasa el menor tiempo en la fase estacionaria y eluye primero (Tabla 2).

Para más información Separation Theory
Como citar este artículo:
APA: (2021-02-24). Separación en cromatografía de gases. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/separacion-en-cromatografia-de-gases/
ACS: . Separación en cromatografía de gases. https://quimicafacil.net/tecnicas-de-laboratorio/separacion-en-cromatografia-de-gases/. Fecha de consulta 2025-07-05.
IEEE: , "Separación en cromatografía de gases," https://quimicafacil.net/tecnicas-de-laboratorio/separacion-en-cromatografia-de-gases/, fecha de consulta 2025-07-05.
Vancouver: . Separación en cromatografía de gases. [Internet]. 2021-02-24 [citado 2025-07-05]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/separacion-en-cromatografia-de-gases/.
MLA: . "Separación en cromatografía de gases." https://quimicafacil.net/tecnicas-de-laboratorio/separacion-en-cromatografia-de-gases/. 2021-02-24. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net