Actualizado en agosto 24, 2021
Tiempo de lectura estimado: 7 minutos
El oxigeno es uno de los elementos más abundantes en la tierra. La atmósfera contiene cerca de 21% de oxigeno elemental libre en su forma diatómica. También se encuentra en combinación con otros elementos en la corteza terrestre, generando una amplia gama de compuestos conocidos como óxidos.
El oxido mas abundante en el planeta es el agua, que es la combinación de dos átomos de hidrógeno y uno de oxígeno, siendo fundamental para los procesos químicos, físicos y biológicos.
El oxigeno
El oxigeno elemental se presenta en estado gaseoso en forma de moléculas diatómicas y exhibe propiedades físicas y químicas peculiares. Por ejemplo. El oxigeno es un gas inodoro e incoloro, con una densidad mayor que la del aire y una baja solubilidad en el agua.
El oxigeno elemental puede ser generado a través de diversas reacciones. Una de esas reacciones parte del peróxido de hidrogeno y un catalizador que acelera la velocidad de reacción de descomposición de dicho compuesto. El peróxido de hidrogeno al descomponerse libera oxigeno elemental y agua.
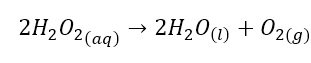
El oxigeno producido se puede recolectar en probetas graduadas empleando el método de desplazamiento de agua o tina neumática, que fue la técnica empleada por los primeros químicos que estudiaron los gases generados en reacciones químicas. El oxigeno recolectado al ser puro permite estudiar varias de sus propiedades.
Una de las reacciones mas comunes del oxigeno es la combustión. Durante la combustión, el oxigeno reacciona con una sustancia que está siendo quemada. Tanto la sustancia quemada como el oxigeno se consumen en la reacción para generar nuevas sustancias y energía en forma de calor.Los productos de la reacción de combustión dependen de la sustancia quemándose y de cuanto oxigeno está presente en la reacción. Generalmente, cuando un elemento puro se quema, el producto es su respectivo oxido siguiendo la siguiente ecuación.
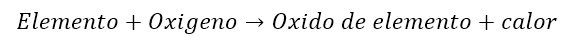
Como el calor es un producto de la reacción, es una reacción exotérmica.
Materiales
- Erlenmeyer de 250 mL
- 5 probetas graduadas de vidrio de 250 mL
- 4 vidrios de reloj
- Tina neumática (o un recipiente profundo con agua)
- Tapón de caucho
- Tubo de Thistle o de seguridad*
- Manguera de goma
- Pinza para balón
- Soporte universal
- Cucharilla de combustión
- Pinza para crisol
- Beaker de 100 mL
Reactivos
- Solución de peróxido de hidrogeno
- Levadura activa
- Astillas de madera
- Velas
- Azufre
- Lana de acero
Procedimiento
Montaje de recolección de oxigeno
Para el montaje de recolección de gas se debe de tener a mano 4 probetas graduadas de 250 mL y tina neumática o un recipiente suficientemente profundo. Llenar con agua la tina. Llenar cada una de las 4 probetas y colocar vidrios de reloj tapando las probetas. De manera cuidadosa voltear boca abajo las probetas en la tina llena de agua, procurando que el liquido contenido en las probetas no se salga. Las bocas de las probetas deben quedar bajo el nivel de agua. Retirar los vidrios de reloj.
En el Erlenmeyer de 250 ml colocar una cucharita de levadura activa junto con 25 mL de agua destilada. Ajustar el Erlenmeyer al soporte universal con la ayuda de la pinza para balón. Realizar el montaje de la figura.
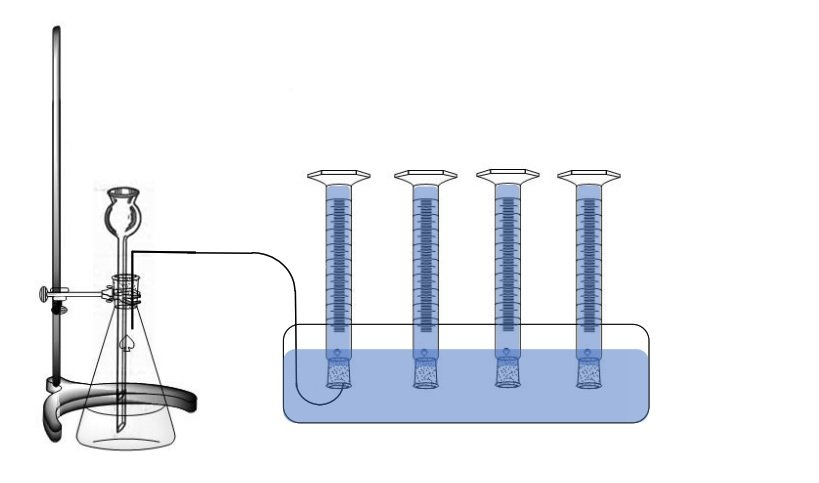
*El tubo de Thistle se utiliza para adicionar líquidos a montajes de manera segura. Se puede reemplazar con una jeringa y aguja para adicionar la solución.
** La tina neumática es un recipiente metálico o de plástico con un soporte interno que facilita la realización de montajes para la recolección y estudio de gases. Si no se dispone de una se puede hacer uso de un recipiente común con el espacio suficiente.
En el beaker pequeño, tomar 30 mL de solución de peróxido de hidrogeno y adicionar cuidadosamente 10 ml a través del tubo thistle. Se iniciará a generar oxigeno de manera inmediata. Si se observa que la cantidad de oxigeno que se burbujea en las probetas comienza a disminuir agregar otros 10 ml de peróxido de hidrogeno.
El oxígeno producido en la reacción desplazara el nivel del agua dentro de la probeta gracias a su baja solubilidad en el líquido. Cuando la probeta se llene con gas, cuidadosamente mover la manguera a la siguiente probeta para iniciar su llenado y así sucesivamente hasta llenar las 4 probetas sumergidas. Tan pronto las probetas estén llenas de gas, retirarlas del montaje colocando un vidrio de reloj en su boca debajo del nivel del agua y sacar el conjunto. Poner boca arriba la probeta sin retirar el vidrio de reloj. Debido a que el oxigeno puro es mas denso que el aire, este permanecerá en el fondo de la probeta y no se escapará rápidamente. Marcar cada probeta en orden con números del 1 al 4. La quinta probeta se marcará con el numero 5 y contiene aire ambiental.
Cuando la totalidad de las probetas estén llenas, cesar la adición de peróxido y dejar que el gas escape hasta que deje de reaccionar. Disponer de manera adecuada de los residuos.
Propiedades del oxígeno
Prueba 1: Combustión de madera
Encender una astilla de madera y después apagar la llama. Mientras aun se observen zonas de combustión incandescente (combustión lenta sin llama), sumergirla en la probeta numero 5 (aire) y observar. Volver a encender y apagar, en esta ocasión sumergirla en la probeta numero 1. Observar.
Prueba 2: Combustión de una vela
Colocar una vela pequeña en una placa de vidrio y encenderla. Tapar la vela con la probeta numero 5 (llena de aire) y medir cuidadosamente los segundos que dura encendida la llama. Repetir el experimento empleando la probeta 2 (llena de oxigeno) y medir los segundos que dura encendida la llama. Comparar.
Prueba 3: Combustión de azufre
Nota: este experimento debe ser realizado en una campana de extracción de gases. Tener cuidado con los gases generados.
Tomar un terrón de azufre en una cucharilla de combustión. Calentarlo al calor de un mechero Bunsen en la cabina de extracción. El azufre se fundirá y posteriormente se quemará con una llama azul tenue. En este momento introducir la cucharilla de combustión en la probeta 5 y observar. Retirar la cucharilla e insertarla en la probeta numero 3. Observar.
Prueba 4: Combustión de hierro
Tomar 30 mL de agua corriente y adicionarla a la probeta 4 cuidadosamente por un costado sin destapar totalmente la probeta. Tomar una hebra de 2 a 3 cm de lana de hierro con las pinzas para crisol y encenderla con la llama de un mechero Bunsen rápidamente (el hierro brillara con un color rojo intenso). Colocar la hebra en la probeta 5 y observar. Repetir el procedimiento y colocar la hebra en la probeta 4 y observar.
Después del experimento
Escribir todas las ecuaciones involucradas en el experimento e identificar los productos de cada una de ellas.
¿Como afecta la presencia de aire puro a las reacciones en comparación a las mismas reacciones, pero llevadas a cabo en aire?
Según las observaciones realizadas en el experimento ¿Cuáles son las principales propiedades físicas y químicas del oxígeno?
Recomendaciones de seguridad
En el presente experimento se generan pequeñas cantidades de oxígeno, así que se debe de tener cuidado de no tener llamas encendidas cerca del montaje cuando se esté generando el gas. Algunas de las reacciones generan como subproductos gases tóxicos, por lo tanto, deben ser realizadas con precaución en cabinas de extracción. Los residuos generados por la practica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información The Properties of Oxygen Gas (Experiment)
Clasificación
Nivel: Superior – universitario
Tipo: Practica de enseñanza
Riesgo: Medio
Como citar este artículo:
APA: (2018-08-22). Propiedades del oxigeno. Recuperado de https://quimicafacil.net/manual-de-laboratorio/propiedades-del-oxigeno/
ACS: . Propiedades del oxigeno. https://quimicafacil.net/manual-de-laboratorio/propiedades-del-oxigeno/. Fecha de consulta 2024-07-27.
IEEE: , "Propiedades del oxigeno," https://quimicafacil.net/manual-de-laboratorio/propiedades-del-oxigeno/, fecha de consulta 2024-07-27.
Vancouver: . Propiedades del oxigeno. [Internet]. 2018-08-22 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/propiedades-del-oxigeno/.
MLA: . "Propiedades del oxigeno." https://quimicafacil.net/manual-de-laboratorio/propiedades-del-oxigeno/. 2018-08-22. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net