Tiempo de lectura estimado: 7 minutos
Diferencias entre mezclas y compuestos
Por mezcla se entiende un conjunto de sustancias que mantienen inalteradas sus características originales y que pueden separarse por medios físicos sencillos.
Por compuesto se entiende una sustancia con características propias que difieren de las de las sustancias que la originaron. Las sustancias originales, los elementos, están siempre en constante relación. Es posible obtener los elementos de un compuesto sólo mediante complejos sistemas químico-físicos (por ejemplo, la electrólisis).
Los compuestos son sustancias puras. Están hechos de los mismos tipos de moléculas. Cada molécula de un compuesto está hecha de dos o más tipos diferentes de átomos que están químicamente unidos. Las mezclas están hechas de dos o más sustancias – elementos o compuestos – que se mezclan físicamente pero no químicamente; no contienen ningún enlace atómico.
Un compuesto contiene átomos de diferentes elementos químicamente combinados entre sí en una proporción fija. Mientras que una mezcla es una combinación de dos o más sustancias en la que no existe una combinación o reacción química.
Los compuestos contienen diferentes elementos en una proporción fija dispuestos de manera definida mediante enlaces químicos. Contienen sólo un tipo de molécula. Los elementos que componen el compuesto están químicamente combinados. Las mezclas contienen diferentes elementos y compuestos, pero la proporción no es fija ni se combinan mediante enlaces químicos. Los ingredientes están físicamente mezclados, pero químicamente separados. A menudo son visiblemente distintos.
Materiales
- 2 vidrios de reloj
- 4 tubos de ensayo
- Pipeta graduada de 10 ml
- Propipeta o pipeteador
- Imán
- Mortero
- Balanza
- Pinzas para tubo de ensayo
- Mechero Bunsen
Reactivos
- Azufre en polvo
- Limadura de hierro
- Solución de ácido clorhídrico 25%
- Sulfuro de carbono
Procedimiento
Primera parte: análisis del comportamiento químico-físico de los reactivos:
Se coloca una pequeña cantidad de limaduras de hierro en el vidrio de reloj. En un segundo vidrio de reloj, se coloca un poco de polvo de azufre.
Al acercarse un imán a las dos sustancias, se observa que el hierro es afectado por el campo magnético que es atraído por el imán. De lo contrario, el azufre no es atraído y, por lo tanto, no se ve afectado por la proximidad de un campo magnético.
El hierro que se adhiere al imán se recupera colocándolo en un tubo de ensayo. En un segundo tubo se pone una pequeña espátula de polvo de azufre. Añade a ambos unos 2 ml de ácido clorhídrico sol 25%
Se observa que el hierro se consume rápidamente con la formación de una solución grisácea y el desarrollo masivo de gas, dependiendo de la reacción:
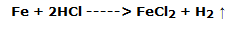
En el segundo tubo, sin embargo, se puede observar que el azufre no se ha disuelto y que una parte flota en la superficie: de hecho, no se ha producido ninguna reacción.
Tomar otros dos tubos y colocar un par de mL de sulfuro de carbono; en uno de los dos tubos se coloca la cantidad que cabe en la punta de una espátula de polvo de hierro y en el segundo una cantidad similar de azufre; se observa que el hierro no da ninguna reacción con el sulfuro de carbono, mientras que el azufre se solubiliza rápidamente, dando una solución débilmente amarilla.
Segunda parte: formación de la mezcla y análisis de su comportamiento:
Pesar 5,6 g de limaduras de hierro y 3,2 g de polvo de azufre; colocar los dos elementos en un pequeño mortero o crisol mezclando y triturando la masa hasta obtener un polvo uniforme de color gris claro; se divide en tres partes.
La primera se toma colocándola en un vidrio de reloj y acercándose a ella con un imán. Observamos la separación del polvo de hierro que se adhiere al imán y es afectado por el campo magnético; sólo el polvo de azufre permanece en el vidrio.

Tome la segunda parte del polvo y colóquela en un tubo de ensayo añadiendo unos 2 mL de ácido clorhídrico sol. 1:3. Se puede ver que el hierro reacciona coloreando la solución de color amarillo-marrón, mientras que el azufre permanece inalterado, tendiendo a colocarse en la superficie.
La reacción que tiene lugar puede describirse como sigue:
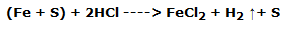
Finalmente, la tercera muestra se coloca en un tubo que contiene 1 o 2 mL de sulfuro de carbono. Se observa que el azufre se disuelve completamente, amarilleando la solución, mientras que el hierro no da ninguna reacción, asentándose en el fondo.
Las pruebas anteriores indican claramente que se trata de una mezcla.
Tercera parte: formación de un compuesto y análisis de su comportamiento:
Se prepara una mezcla como en la etapa anterior, teniendo cuidado de añadir un exceso de azufre, alrededor de 1 ó 2 g (véase la nota más adeante) y ponerla en un tubo de ensayo seco. Se acerca el tubo a la llama de un mechero Bunsen, sosteniéndolo con unas pinzas, y se pone gradualmente al rojo vivo; después de esto, se deja enfriar por unos momentos y se rompe el vidrio recuperando la masa de color oscuro que se ha formado.
La misma se recoge en el mortero, se reduce a polvo y se divide en tres partes.
La primera parte se coloca en el cristal de un reloj, acercándose al imán; observar lo sucedido
La segunda parte se coloca en un tubo de ensayo y se hace reaccionar con ácido clorhídrico; se produce una reacción química con la producción de un gas con olor a huevo podrido, sulfuro de hidrógeno y el oscurecimiento progresivo de la solución, según la reacción:
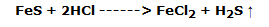
Finalmente, la parte restante se coloca en un tubo que contiene 1 ó 2 mL de sulfuro de carbono, observando que no se produce ningún fenómeno químico-físico.
Estos hechos indican claramente un comportamiento químico diferente al de los elementos de origen y, por lo tanto, la formación de un compuesto, el sulfuro de hierro II, según la reacción:
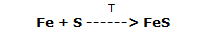
Nota: la formación de sulfuro de hierro, para que tenga las características descritas, debe tener lugar con una completa puesta al rojo vivo. Dado que el azufre tiende a fundirse y evaporarse, es necesario operar con el exceso de este. De lo contrario, parte del hierro no reacciona, dando al compuesto una capacidad relativa de ser afectado por el magnetismo.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Prestar mucha atención en el uso del sulfuro de carbono, evitando acercarse a las llamas; si es posible realizar la reacción en una cabina de extracción.
Se debe tener cuidado de no inhalar vapores de sulfuro de carbono, ya que es toxico.
Para más información I miscugli ed i composti
Como citar este artículo:
APA: (2021-02-10). Mezclas y compuestos. Recuperado de https://quimicafacil.net/manual-de-laboratorio/q-general-basica/mezclas-y-compuestos/
ACS: . Mezclas y compuestos. https://quimicafacil.net/manual-de-laboratorio/q-general-basica/mezclas-y-compuestos/. Fecha de consulta 2025-07-06.
IEEE: , "Mezclas y compuestos," https://quimicafacil.net/manual-de-laboratorio/q-general-basica/mezclas-y-compuestos/, fecha de consulta 2025-07-06.
Vancouver: . Mezclas y compuestos. [Internet]. 2021-02-10 [citado 2025-07-06]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/q-general-basica/mezclas-y-compuestos/.
MLA: . "Mezclas y compuestos." https://quimicafacil.net/manual-de-laboratorio/q-general-basica/mezclas-y-compuestos/. 2021-02-10. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net