Actualizado en enero 9, 2024
Tiempo de lectura estimado: 10 minutos
La materia puede sufrir tres tipos de transformaciones; físicos, químicos y nucleares. Mientras que la composición de una sustancia química no es alterada por los cambios físicos como el congelamiento y la evaporación, los cambios químicos o reacciones, resultan en la formación de nuevas sustancias cuando se generan o se rompen enlaces. Existen muchos tipos de reacciones, sin embargo, la mayoría pueden clasificarse en algunas categorías.
Reacciones químicas y sus tipos
Las reacciones químicas se pueden definir como la interacción de átomos que conllevan a la formación o el rompimiento de enlaces entre los mismos. Los átomos pueden provenir de un elemento o de un compuesto y la reacción química puede generar igualmente elementos puros o compuestos. A las sustancias que sufren la transformación se les llama reactivos o reactantes, mientras que las sustancias producidas por la transformación se les da el nombre de productos. La cantidad de reactivos que pueden intervenir en una reacción no tiene límite, pueden ser 1 (como en el caso de una reacción de descomposición) o cientos, como es el caso de las reacciones que pueden darse en un alto horno. Igualmente, la cantidad de productos pueden llegar a ser uno o cientos.
Cuando una reacción química ocurre, a menudo es acompañada por cambios observables a simple vista y cuantificables, incluyendo cambios en el color, formación de un precipitado (sustancia insoluble que se observa en la parte inferior del recipiente de reacción), generación de un gas observable a través de burbujeo, aparición o desaparición de fases entre dos líquidos, absorción o generación de calor apreciable a través de un cambio en la temperatura del recipiente, formación de una capa metálica o la desaparición de un metal en una solución. Los anteriores fenómenos pueden aparecer de manera individual o varios a la vez y facilitan el estudio y comprensión de los fenómenos de reacción.
Tipos de reacción
Las reacciones químicas pueden clasificarse en varios tipos, algunas reacciones pueden etiquetarse en varios tipos de reacción, por ejemplo, las reacciones de combinación y descomposición en las cuales están presentes elementos puros también son reacciones de oxido-reducción.
- Reacciones de combinación o síntesis: Estas ocurren cuando dos o mas sustancias, bien sea elementos o compuestos, se combinan para formar una nueva sustancia, por ejemplo, cuando el hidrógeno y el oxigeno gaseosos se combinan para formar agua.
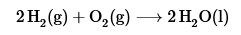
- Reacciones de descomposición: sucede cuando un compuesto se separa en dos o mas sustancias. Un ejemplo es cuando el clorato de potasio se descompone al ser calentado en cloruro de potasio y oxigeno gaseoso. El clorato de potasio es uno de los ingredientes usados en los cerillos.
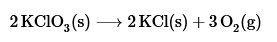
- Reacciones de desplazamiento: También conocidas como reacciones de desplazamiento simple, involucra el desplazamiento de un elemento en un compuesto por otro elemento, existen muchos ejemplos de este tipo de reacción, uno de ellos es el desplazamiento del cobre presente en una solución de nitrato de cobre (II) por plomo en estado sólido, el cobre se observa como un polvo en el fondo del recipiente. En este caso también se presenta una oxido-reducción, debido al cambio de los estados de oxidación tanto del plomo como del cobre.
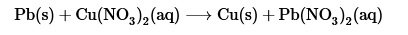
- Reacciones de intercambio o de doble desplazamiento: estas reacciones suceden cuando dos compuestos intercambian sus componentes, es decir, intercambian sus pares de anión – catión, generando dos compuestos diferentes. A este tipo de reacciones también se le conoce como reacciones de metátesis. Tienen la siguiente formula general

Un ejemplo de este tipo de reacción es la generación de fosfato de calcio y cloruro de sodio a partir de cloruro de calcio y fosfato de sodio
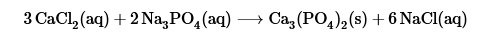
Materiales
- Pinzas para crisol
- 13 tubos de ensayo
- Gradilla
- 3 Beaker de 100 mL
- Papel tornasol rojo y azul
- Mechero Bunsen
- Varilla de agitación
Reactivos
- Soluciones
- Acido clorhídrico 6 M
- Hidróxido de sodio 6 M
- Nitrato de amonio 1 M
- Sulfato de cobre 0.1 M
- Sulfato de zinc 0.1 M
- Nitrato de plata 0.1 M
- Cloruro de sodio 0.1 M
- Nitrato de níquel (II) 0.1 M
- Nitrato de plomo (II) 0.1 M
- Cromato de potasio 0.1 M
- Oxido de calcio previamente preparado
- Acido sulfúrico 18 M
- Solidos:
- Magnesio en tiras
- Sulfato de cobre (II) pentahidratado
- Calcio
- Cobre
- Zinc
- Carbonato acido de sodio
- Sodio metálico
Procedimiento
Reacciones de combinación

- Colocar 35 mL de solución saturada de oxido de calcio en un beaker de 100 mL, dejar en reposo por espacio de 15 minutos y observar. Con la ayuda de un tubo hueco, burbujear aire soplando en el por unos pocos segundos. Observar la solución nuevamente. Anotar las observaciones*
- Sostener una tira de magnesio metálico empleando las pinzas para crisol, encender el mechero Bunsen y encender la tira en la parte más caliente de la llama del mechero, observar el color de la llama y de los residuos que quedan en las pinzas. Anotar las observaciones
*Estas reacciones deben ser llevadas a cabo por el docente a cargo si los estudiantes no poseen las suficientes habilidades de laboratorio.
Reacciones de descomposición
- (Esta reacción se debe llevar a cabo en una campana de extracción o de gases) En un beaker de 100 mL, colocar azúcar granulada hasta 1/3 de su capacidad o menos y adicionar 20 mL de ácido sulfúrico 18 M. Agitar hasta asegurar mezcla completa. Mantener la agitación hasta que la mezcla se oscurezca. Con la ayuda de la varilla de agitación retirar un poco de los productos generados en la reacción. Anotar las observaciones*
- Colocar una pequeña cantidad (lo que se puede recoger en la punta de una espátula) de sulfato de cobre (II) pentahidratado en un tubo de ensayo. Usar una pinza para tubos de ensayo para sujetarlo y calentar el tubo por unos minutos en el mechero Bunsen con un Angulo de 45° teniendo la precaución de no apuntar la boca del tubo hacia alguna persona. Observar los cambios en el solido y en el tubo de ensayo. Dejar enfriar el tubo de ensayo y agregar unas gotas de agua destilada. Observar y anotar.
*Estas reacciones deben ser llevadas a cabo por el docente a cargo si los estudiantes no poseen las suficientes habilidades de laboratorio.
Reacciones de desplazamiento
En las siguientes reacciones emplear 1 mL de solución de cada una a menos que se indique lo contrario. Cuando se empleen sólidos, solo utilizar una pequeña cantidad. Si no se observa reacción de manera inmediata, dejar en reposo entre 5 a 10 minutos para observar si se genera alguna reacción. No todas las combinaciones terminaran en reacción. Si se tiene alguna duda, se puede repetir la reacción para determinar si se genera o no.
- Colocar 50 ml de agua en un beaker de 100 mL y adicionar un pedazo pequeño de sodio metálico. Observar la reacción en un lugar con poca luz. Ensayar la solución resultante con papel tornasol azul y rojo (tomar una pequeña gota de la solución con una varilla de agitación de vidrio limpia y humedecer un trozo de papel tornasol de cada color) anotar todas las observaciones que se realicen*
En tubos de ensayo realizar las siguientes combinaciones de reactivos de manera cuidadosa. Si es necesario, marcar cada tubo para identificar que reacción se está llevando a cabo en cada uno:
- Calcio metálico y 15 mL de agua (se puede hacer en un tubo de ensayo grande o en un beaker pequeño
- Zinc metálico y agua destilada
- Cobre metálico y ácido clorhídrico 6 M
- Zinc metálico y ácido clorhídrico 6 M
- Zinc metálico y Sulfato de cobre (II) 0.1 M
- Cobre metálico y sulfato de zinc 0.1 M
- Cobre metálico y nitrato de plata 0.1 M
*Estas reacciones deben ser llevadas a cabo por el docente a cargo si los estudiantes no poseen las suficientes habilidades de laboratorio.
Reacciones de intercambio
Emplear 1 mL de cada solución a menos que se especifique lo contrario. Mezclar bien las soluciones:
- Nitrato de plata 0.1 M y cloruro de sodio 0.1 M
- Nitrato de níquel (II) 0.1 M y tres gotas de hidróxido de sodio 6 M
- Nitrato de plomo (II) 0.1 M y cromato de potasio 0.1 M
- Nitrato de amonio 1 M e hidróxido de sodio 6 M. Calentar el tubo de ensayo suavemente pasándolo 4 veces a través de la llama del mechero Bunsen. Mantener una tira de papel tornasol rojo humedecido con agua destilada en la boca del tubo sin dejarlo entrar en contacto con las paredes de este y observar si hay un cambio en el color.
- Colocar 5 mL de ácido clorhídrico 6 M en un beaker de 100 mL. Cuidadosamente agregar varias espátulas de carbonato ácido de sodio. Observar.
- Mezclar 5 mL de hidróxido de sodio 6 M y 5 mL de ácido sulfúrico en un beaker pequeño. Mezclar con una varilla de agitación limpia. Observar con el tacto si se genera algún cambio en la temperatura del recipiente (sin retirarse los guantes de seguridad). Utilizando un termómetro observar si se genera un aumento en la temperatura.
*Estas reacciones deben ser llevadas a cabo por el docente a cargo si los estudiantes no poseen las suficientes habilidades de laboratorio.
Después del experimento
Escribir las ecuaciones balanceadas de las reacciones generadas en el laboratorio. En cada una realizar las anotaciones sobre los productos obtenidos (gases, sólidos, precipitados, colores, aumento o disminución de temperatura, etc.) Realizar los cálculos estequiométricos de cada reacción y determinar que sustancia es el reactivo limite y cual es el reactivo en exceso.
Recomendaciones de seguridad
Se deben manejar con cuidado las soluciones 6 M y 3 M. no mirar de manera directa la llama generada en la combustión de la tira de magnesio. Evitar el contacto con la piel de la solución de nitrato de plata, ya que genera decoloración en la piel. No tocar los sólidos con la piel desnuda. En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la practica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Types of Chemical Reactions (Experiment)
Como citar este artículo:
APA: (2018-10-03). Tipos de reacciones químicas (experimento). Recuperado de https://quimicafacil.net/manual-de-laboratorio/tipos-de-reacciones-quimicas/
ACS: . Tipos de reacciones químicas (experimento). https://quimicafacil.net/manual-de-laboratorio/tipos-de-reacciones-quimicas/. Fecha de consulta 2024-07-27.
IEEE: , "Tipos de reacciones químicas (experimento)," https://quimicafacil.net/manual-de-laboratorio/tipos-de-reacciones-quimicas/, fecha de consulta 2024-07-27.
Vancouver: . Tipos de reacciones químicas (experimento). [Internet]. 2018-10-03 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/tipos-de-reacciones-quimicas/.
MLA: . "Tipos de reacciones químicas (experimento)." https://quimicafacil.net/manual-de-laboratorio/tipos-de-reacciones-quimicas/. 2018-10-03. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net