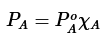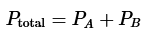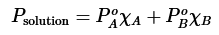Actualizado en enero 9, 2024
Tiempo de lectura estimado: 4 minutos
La destilación simple es un método de purificación de líquidos, y puede separar componentes de una mezcla si tienen puntos de ebullición significativamente diferentes.
En una destilación, un líquido es hervido en el «matraz de destilación», luego los vapores viajan a otra sección del aparato donde entran en contacto con una superficie fría. Los vapores se condensan en esta superficie fría, y el líquido condensado (llamado «destilado») gotea en un depósito separado del líquido original. En los términos más sencillos, una destilación implica hervir un líquido, luego condensar el gas y recogerlo en otro lugar.
Usos de la destilación simple
La destilación es el método utilizado para concentrar soluciones fermentadas y producir licores duros. La destilación es también una excelente herramienta de purificación para muchos líquidos, y puede utilizarse para purificar productos de una reacción química.
Teoría de la separación
La destilación de mezclas puede o no producir muestras relativamente puras. Como la destilación consiste en hervir una solución y condensar sus vapores, la composición del destilado es idéntica a la de los vapores. Se pueden utilizar varias ecuaciones para describir la composición del vapor producido a partir de una solución.
La ley de Raoult establece que la presión de vapor de un compuesto disminuye cuando es parte de una solución y es proporcional a su composición molar. La ley de Raoult se muestra en la siguiente ecuación
donde P°A es la presión de vapor de una muestra de A puro, y xA es la fracción molar de A en la mezcla.
La ecuación significa que una solución que contiene 80% molar de compuesto «A» y 20% molar de otro componente miscible produciría en equilibrio el 80% de las partículas del compuesto A en la fase gaseosa en comparación a que si el compuesto A estuviera en forma pura.
La ley de Dalton de presiones parciales establece que la presión total en un sistema cerrado se puede encontrar mediante la adición de las presiones parciales de cada componente gaseoso. La ley de Dalton se muestra en la siguiente ecuación
Una combinación de las leyes de Raoult y Dalton se muestra en la siguiente ecuación, que describe el vapor producido por un sistema de dos componentes miscible (compuestos A + B). Esta ley combinada muestra que los vapores producidos por la destilación dependen de la presión y cantidad de vapor de cada componente (fracción molar).
La presión de vapor de un compuesto refleja la temperatura de la solución, así como el punto de ebullición del compuesto. A medida que aumenta la temperatura, un mayor porcentaje de moléculas tienen energía suficiente para superar las fuerzas intermoleculares que las sostienen en la fase líquida. Por lo tanto, la presión de vapor de un compuesto siempre aumenta con la temperatura, aunque no de manera lineal.
Al comparar dos compuestos a la misma temperatura, el compuesto con las fuerzas intermoleculares más débiles (el que tiene el punto de ebullición más bajo) debería entrar más fácilmente en la fase gaseosa. Por lo tanto, a cualquier temperatura, un compuesto con un punto de ebullición más bajo siempre tiene una presión de vapor mayor que un compuesto con un punto de ebullición más alto. Este último concepto es la piedra angular de la teoría de la destilación.
Potencial de purificación de la destilación simple
Una destilación simple funciona bien para purificar ciertas mezclas, específicamente para separar un líquido de impurezas no volátiles (por ejemplo, sólidos o sales), o de pequeñas cantidades de impurezas de menor o mayor punto de ebullición.
Una pauta general es que una destilación simple es capaz de separar componentes si la diferencia en el punto de ebullición de los componentes es superior a 100°C. Una simple destilación no funciona bien para purificar una mezcla que contiene componentes con puntos de ebullición similares (cuando la diferencia en los puntos de ebullición es menor a 100°C).
Para mas información Simple Distillation
Como citar este artículo:
APA: (2020-01-15). Introducción a la Destilación simple. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-destilacion-simple/
ACS: . Introducción a la Destilación simple. https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-destilacion-simple/. Fecha de consulta 2024-07-27.
IEEE: , "Introducción a la Destilación simple," https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-destilacion-simple/, fecha de consulta 2024-07-27.
Vancouver: . Introducción a la Destilación simple. [Internet]. 2020-01-15 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-destilacion-simple/.
MLA: . "Introducción a la Destilación simple." https://quimicafacil.net/tecnicas-de-laboratorio/introduccion-destilacion-simple/. 2020-01-15. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net