Tiempo de lectura estimado: 4 minutos
El balón Claisen o matraz de destilación Claisen es un tipo especial de matraz de destilación utilizado en varios procedimientos, como la destilación al vacío. Fue inventado por Rainer Ludwig Claisen.
Historia del balón de Claisen
Ludwig Claisen nació en Colonia en 1851 y estudió en Bonn con August Kekule, donde se despertó su interés por los carbonilos y los enolatos. En 1881 publicó un trabajo seminal sobre lo que se conocería como la reacción Claisen-Schmidt, una condensación cruzada de aldol. En 1886 se unió al grupo de Adolf von Baeyer, donde informó de la condensación entre un éster y una cetona, la reacción de Claisen, que sigue siendo una piedra angular de la síntesis orgánica.
Irónicamente, dada la futura inclinación de Claisen por la invención, von Baeyer era muy reacio a que se introdujeran nuevos aparatos de química en su laboratorio de Múnich. Cuando se dispuso de agitadores accionados por agua, sus estudiantes se unieron y decidieron instalarlos en secreto durante la noche, y luego presentarle a su jefe un hecho consumado.
A la mañana siguiente, cuando Baeyer hizo sus rondas, frunció el ceño ante el ruido del equipo. Sin decir una palabra, dejó el laboratorio y se fue a casa a buscar a su esposa, Lydia. Su entusiasmo fue inmediato. «Qué manera tan maravillosa de hacer mayonesa», exclamó, y Baeyer se vio obligado a capitular.
Destilación al vacío
Claisen aceptó la cátedra de química orgánica en Aquisgrán en 1890. La destilación al vacío acababa de ser inventada, y era una de las operaciones más difíciles para un químico. El problema eran las burbujas: bajo el vacío, los gránulos anti-bumping – esas fuentes esenciales de nucleación heterogénea – se volvieron semi-inútiles. Las destilaciones se convirtieron en una pesadilla de frustración enloquecedora y espumosa, alternando con protuberancias que paraban el corazón y que arrojaban la mitad del contenido del alambique al receptor.
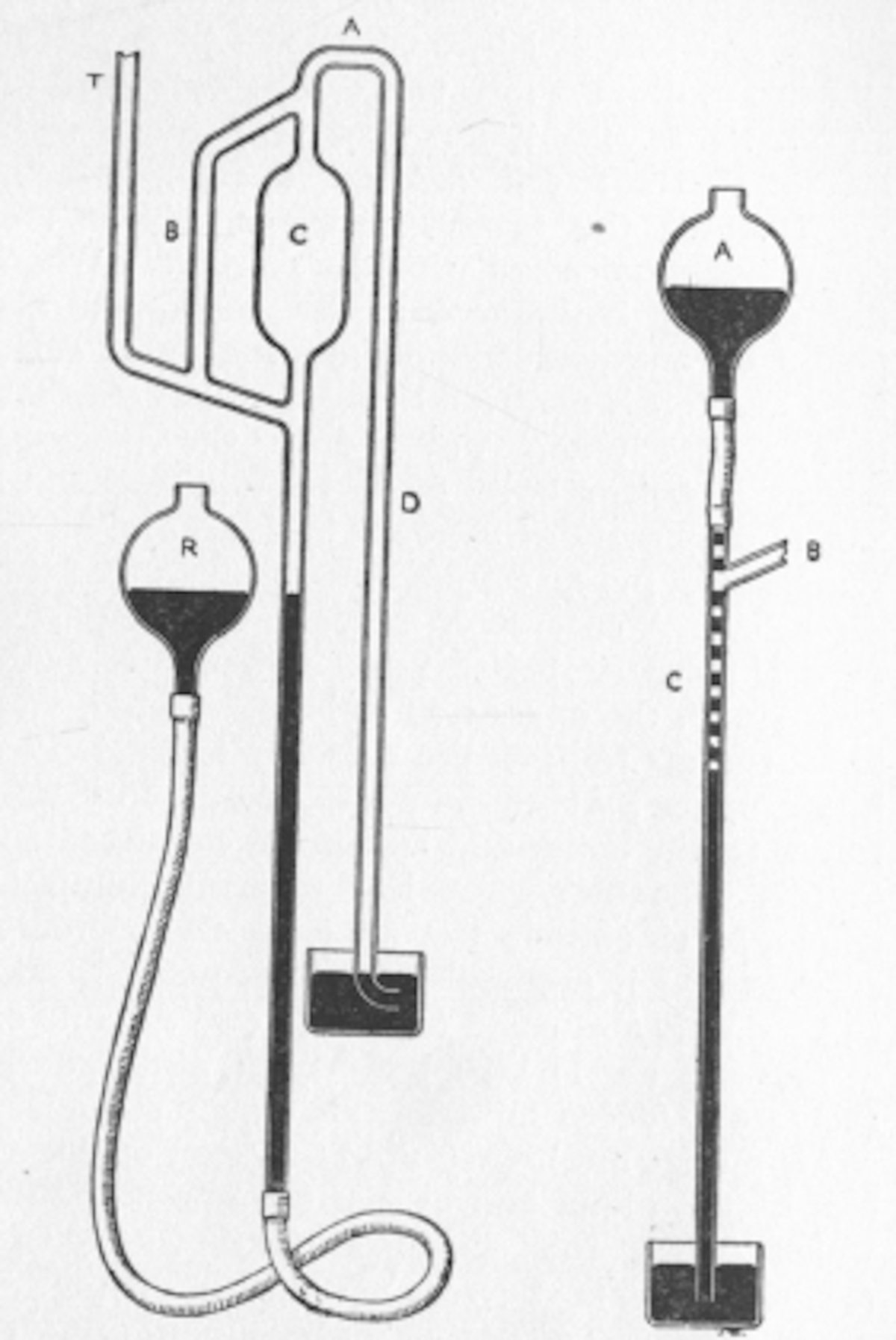
En 1867, un oscuro químico italiano, Pietro Pellogio, introdujo la idea de insertar un capilar en el frasco junto al termómetro, para introducir una fina corriente de burbujas en el líquido, suavizando el proceso de ebullición. El sucesor de Claisen en Bonn, Richard Anschutz, publicó una monografía sobre la destilación al vacío en 1887, proponiendo que el termómetro se colocara dentro de una pipeta Pasteur insertada a través de un corcho en la parte superior del matraz. Todo era un procedimiento muy complicado.
El diseño del balón
La solución de Claisen fue diseñar un matraz con, en esencia, dos cabezales de alambique apilados uno sobre el otro, el primero para sujetar el capilar y el segundo para el termómetro. Aunque enterrado en un papel de 1893 sobre cetonas, pronto se utilizó ampliamente. Fue tan inteligente que al año siguiente un químico llamado Lederer publicó algo similar en el Chemisches-Zeitung sin dar crédito a Claisen. Claisen respondió con una carta comedida pero firme al editor llamando la atención tanto sobre su artículo original como sobre uno en el que William Perkin Jr. de Inglaterra había señalado que era «muy útil».
Claisen se trasladó a Kiel, pero los problemas de salud pronto lo obligaron a renunciar. Después de una corta estancia en el Instituto de Berlín de Emil Fischer, se retiró a la pequeña ciudad de Godesberg, donde estableció su propio laboratorio casero. No era un simple cobertizo en el fondo del jardín, estaba completamente equipado, y Claisen continuó haciendo ciencia en serio. En 1912 descubrió la primera reacción sigmatrópica, la reorganización de Claisen, la conversión de los éteres vinílicos alílicos en cetonas no saturadas g,d. Claisen continuó publicando hasta cuatro años antes de su muerte en 1930.
Usos
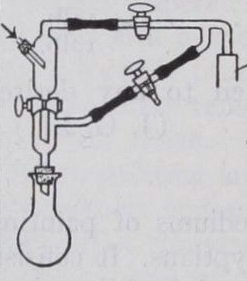
El balón Claisen se utiliza generalmente para la destilación a presión reducida. El matraz fue diseñado para reducir la probabilidad de tener que repetir la destilación, debido al choque del líquido en ebullición. Es similar a un balón Würtz, aunque la característica distintiva del matraz Claisen es un cuello en forma de U fusionado en la parte superior del matraz. El matraz en sí mismo es a menudo de fondo redondo o en forma de pera. La forma de U (o bifurcación) es similar a la de un adaptador Claisen, de ahí el nombre. Este diseño hace imposible que cualquier salpicadura de líquido de destilación proyectada por golpes llegue al destilado.
Algunos balones Claisen tienen una columna fraccionadora corta en el brazo lateral. Generalmente los balones Claisen están hechos de vidrio borosilicato de buena calidad.
Para más información Classic Kit: Claisen’s flask
Como citar este artículo:
APA: (2019-07-08). Balón o matraz de Claisen. Recuperado de https://quimicafacil.net/infografias/material-de-laboratorio/balon-o-matraz-de-claisen/
ACS: . Balón o matraz de Claisen. https://quimicafacil.net/infografias/material-de-laboratorio/balon-o-matraz-de-claisen/. Fecha de consulta 2025-12-31.
IEEE: , "Balón o matraz de Claisen," https://quimicafacil.net/infografias/material-de-laboratorio/balon-o-matraz-de-claisen/, fecha de consulta 2025-12-31.
Vancouver: . Balón o matraz de Claisen. [Internet]. 2019-07-08 [citado 2025-12-31]. Disponible en: https://quimicafacil.net/infografias/material-de-laboratorio/balon-o-matraz-de-claisen/.
MLA: . "Balón o matraz de Claisen." https://quimicafacil.net/infografias/material-de-laboratorio/balon-o-matraz-de-claisen/. 2019-07-08. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net