El descubrimiento de la mecánica cuántica ayudó a reforzar los fundamentos de la tabla periódica, llevándola más allá de una simple lista
Tiempo de lectura estimado: 3 minutos
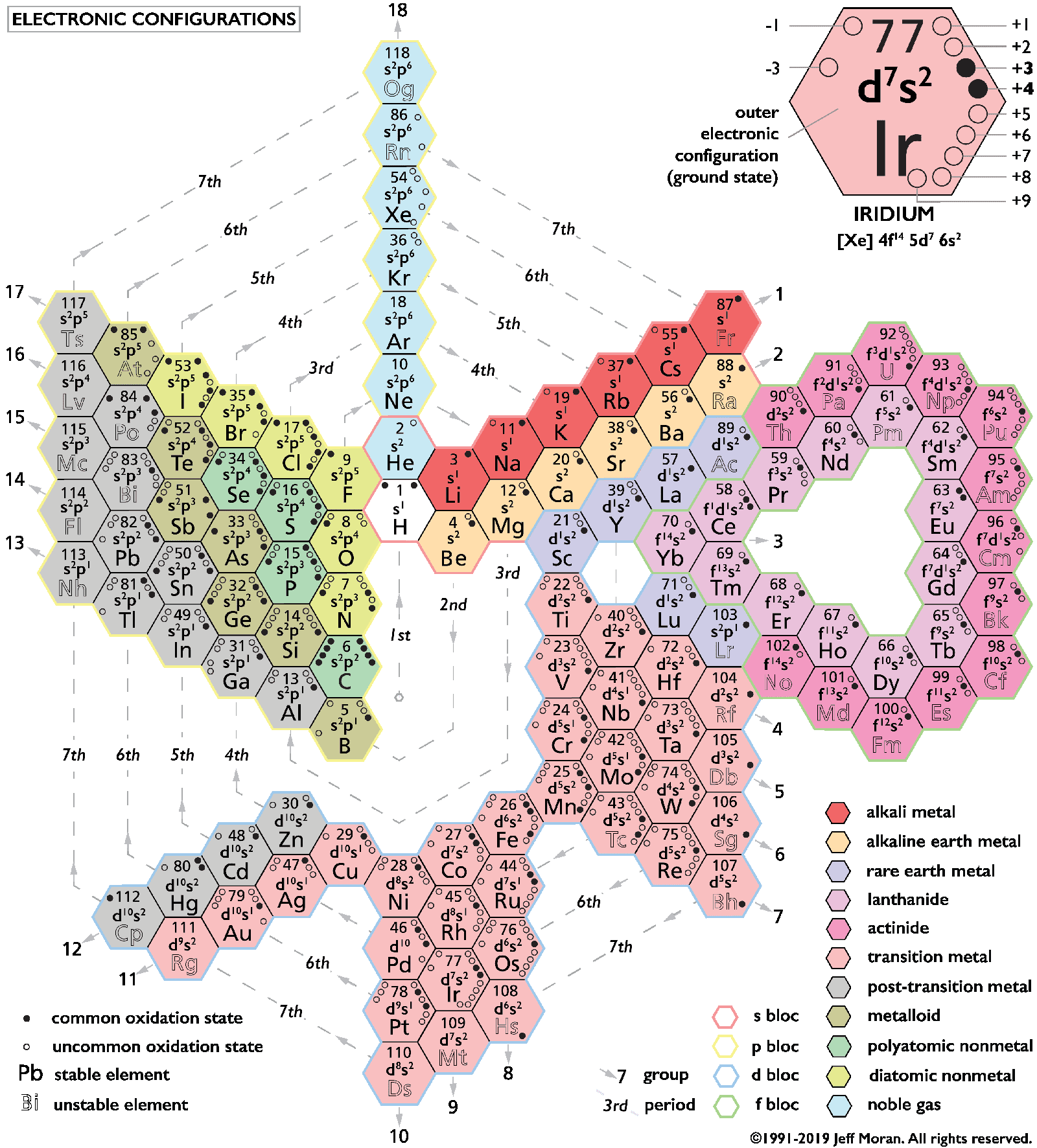
La tabla periódica cuántica
En las décadas de 1910 y 1920, la investigación pionera en mecánica cuántica condujo a nuevos desarrollos en la teoría atómica y a pequeños cambios en la tabla periódica.
El modelo de Niels Bohr fue desarrollado durante este tiempo, y defendió la idea de configuraciones de electrones que determinan las propiedades químicas. Bohr propuso que los elementos del mismo grupo se comportaran de manera similar porque tienen configuraciones electrónicas similares, y que los gases nobles habían llenado las capas de valencia; esto constituye la base de la moderna regla del octeto.
Esta investigación llevó al físico austriaco Wolfgang Pauli a investigar la duración de los períodos en la tabla periódica de 1924. Mendeleev afirmó que había una periodicidad fija de ocho, y esperaba una correlación matemática entre el número atómico y las propiedades químicas; Pauli demostró que este no era el caso.
En su lugar, se desarrolló el principio de exclusión de Pauli. En él se afirma que ningún electrón puede coexistir en el mismo estado cuántico y se muestra, junto con las observaciones empíricas, la existencia de cuatro números cuánticos y sus consecuencias en el orden de llenado de las capas, lo que determina el orden en que se llenan las capas de electrones y explica la periodicidad de la tabla periódica.
Elementos de transición
Al químico británico Charles Bury se le atribuye el primer uso del término metal de transición en 1921 para referirse a los elementos entre los elementos del grupo principal de los grupos II y III. Explicó las propiedades químicas de los elementos de transición como consecuencia del relleno de una subestructura interior en lugar de la capa de valencia.
Esta proposición, basada en el trabajo del químico estadounidense Gilbert N. Lewis, sugirió la aparición de la subcapa d en el período 4 y la subcapa f en el período 6, alargando los períodos de 8 a 18 y luego de 18 a 32 elementos.
Para más información Evolution and understanding of the d-block elements in the periodic table
Artículos en esta serie
- Historia de la tabla periódica I
- Historia de la tabla periódica II
- Historia de la tabla periódica III
- Historia de la tabla periódica IV
- Historia de la tabla periódica IX
- Historia de la tabla periódica V
- Historia de la tabla periódica VI
- Historia de la tabla periódica VII
- Historia de la tabla periódica VIII
- Historia de la tabla periódica X
Como citar este artículo:
APA: (2019-03-25). Historia de la tabla periódica VIII. Recuperado de https://quimicafacil.net/infografias/historia-de-la-tabla-periodica-viii/
ACS: . Historia de la tabla periódica VIII. https://quimicafacil.net/infografias/historia-de-la-tabla-periodica-viii/. Fecha de consulta 2026-02-20.
IEEE: , "Historia de la tabla periódica VIII," https://quimicafacil.net/infografias/historia-de-la-tabla-periodica-viii/, fecha de consulta 2026-02-20.
Vancouver: . Historia de la tabla periódica VIII. [Internet]. 2019-03-25 [citado 2026-02-20]. Disponible en: https://quimicafacil.net/infografias/historia-de-la-tabla-periodica-viii/.
MLA: . "Historia de la tabla periódica VIII." https://quimicafacil.net/infografias/historia-de-la-tabla-periodica-viii/. 2019-03-25. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net