Tiempo de lectura estimado: 6 minutos
Diseñado por el químico y científico escoces James Dewar en 1892, el frasco de Dewar o frasco al vacío consiste en dos frascos concéntricos, donde el espacio entre ellos tiene un vacío parcial, que disminuye el intercambio de calor con el medio ambiente
Un frasco al vacío (también conocido como frasco Dewar, botella Dewar o termo) es un recipiente de almacenamiento aislante que prolonga enormemente el tiempo durante el cual su contenido permanece más caliente o frío que los alrededores del frasco.
Inventado por Sir James Dewar en 1892, el matraz al vacío consiste en dos frascos, colocados uno dentro del otro y unidos por el cuello. El espacio entre los dos frascos es parcialmente evacuado de aire, creando un casi vacío que reduce significativamente la transferencia de calor por conducción o convección.
Los frascos al vacío se utilizan en el ámbito doméstico, para mantener las bebidas calientes o frías durante largos períodos de tiempo, y para muchos fines en la industria.
Historia del frasco Dewar
El frasco de vacío fue diseñado e inventado por el científico escocés Sir James Dewar en 1892 como resultado de sus investigaciones en el campo de la criogenia y a veces se le llama frasco Dewar en su honor.
Mientras realizaba experimentos para determinar el calor específico del elemento paladio, Dewar hizo una cámara de latón que encerró en otra cámara para mantener el paladio a la temperatura deseada. Evacuó el aire entre las dos cámaras, creando un vacío parcial para mantener estable la temperatura del contenido. A través de la necesidad de este contenedor aislado James Dewar creó el frasco de vacío, que se convirtió en una herramienta importante para los experimentos químicos y también se convirtió en un artículo doméstico común. El frasco fue desarrollado más tarde utilizando nuevos materiales como el vidrio y el aluminio, sin embargo, Dewar se negó a patentar su invento.
Comercialización del frasco de vacío
El diseño de Dewar se transformó rápidamente en un artículo comercial en 1904 cuando dos sopladores de vidrio alemanes, Reinhold Burger y Albert Aschenbrenner, descubrieron que podía utilizarse para mantener frías las bebidas frías y calientes las bebidas calientes e inventaron un diseño de matraz más robusto, adecuado para el uso cotidiano. El diseño del matraz de Dewar nunca se había patentado, pero los hombres alemanes que descubrieron el uso comercial del producto lo llamaron Thermos, y posteriormente reivindicaron tanto los derechos del producto comercial como la marca del nombre.
En su posterior intento de reclamar los derechos sobre el invento, Dewar perdió en cambio un juicio a favor de la empresa. La fabricación y el rendimiento de la botella de termo fue mejorada y refinada significativamente por el inventor y comerciante vienés Gustav Robert Paalen, que diseñó varios tipos para uso doméstico, que también patentó, y distribuyó ampliamente, a través de las empresas de botellas de termo en los Estados Unidos, Canadá y el Reino Unido, que compraron licencias para los respectivos mercados nacionales.
La American Thermos Bottle Company construyó una producción en masa en Norwich, CT, lo que hizo bajar los precios y permitió la amplia distribución del producto para uso doméstico. Con el tiempo, la empresa amplió el tamaño, las formas y los materiales de estos productos de consumo, utilizados principalmente para llevar café en los viajes y llevar líquidos en los viajes de camping para mantenerlos calientes o fríos. Con el tiempo, otros fabricantes produjeron productos similares para el uso de los consumidores.
El nombre se convirtió más tarde en una marca comercial generalizada después de que el término «termo» se convirtiera en el nombre familiar de dicho recipiente aislado al vacío para líquidos. El termo al vacío pasó a utilizarse para muchos tipos diferentes de experimentos científicos y el «termo» comercial se transformó en un artículo común. Thermos sigue siendo una marca registrada en algunos países, pero fue declarada una marca generalizada por una acción judicial en los Estados Unidos en 1963, ya que se había convertido coloquialmente en sinónimo de frascos al vacío en general. Sin embargo, hay otros frascos al vacío.
Diseño de un frasco Dewar o frasco al vacío
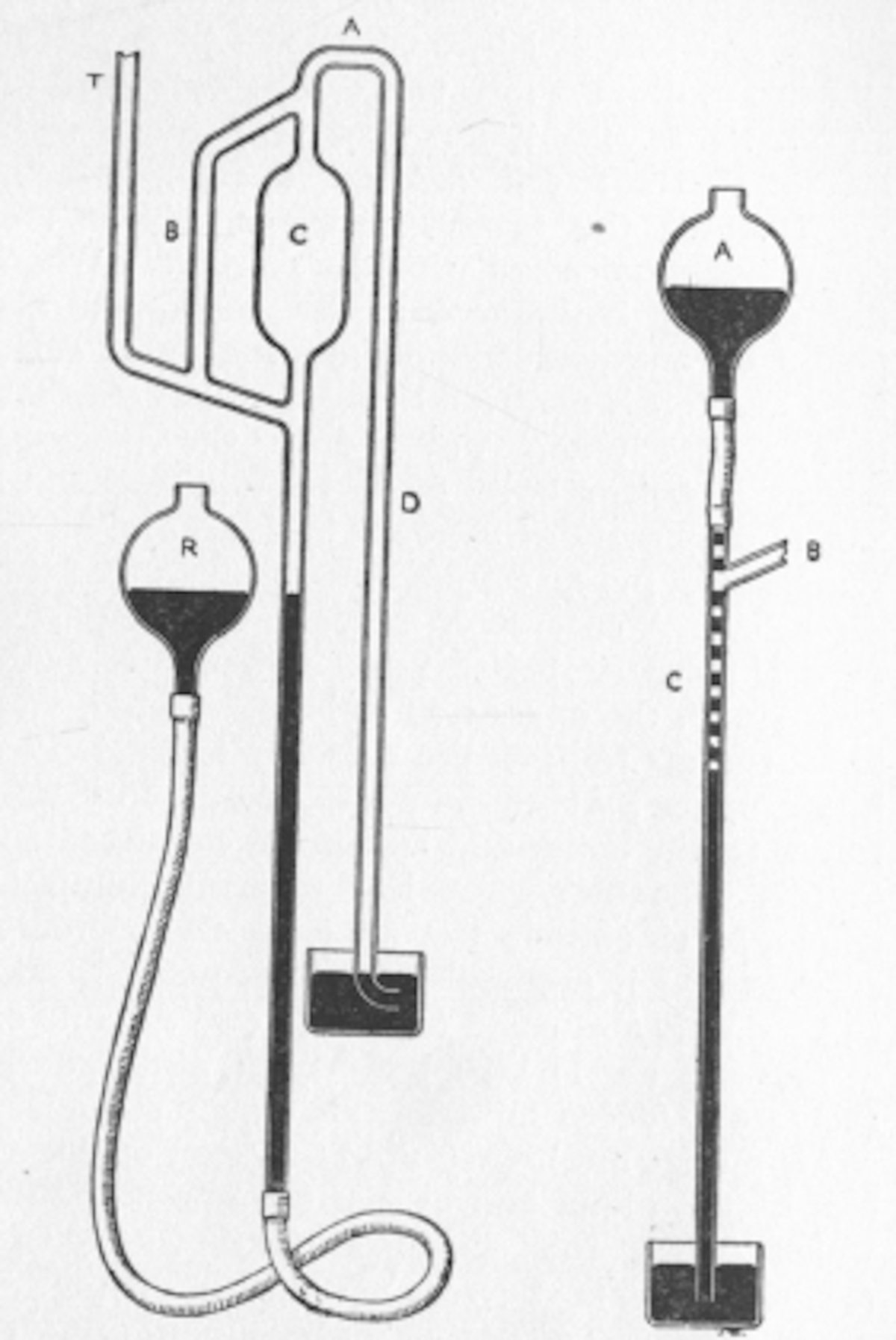
El frasco de vacío consiste en dos vasos, uno colocado dentro del otro y unido en el cuello. El espacio entre los dos vasos es parcialmente evacuado de aire, creando un vacío parcial que reduce la conducción de calor o convección. La transferencia de calor por radiación térmica puede reducirse al mínimo plateando las superficies del matraz que se encuentran dentro del espacio vacio, pero puede resultar problemático si el contenido del matraz o los alrededores están muy calientes; por lo tanto, los matraces al vacío suelen mantener el contenido por debajo del punto de ebullición del agua.
La mayor parte de la transferencia de calor se produce a través del cuello y la abertura del matraz, donde no hay vacío. Los frascos al vacío suelen ser de metal, vidrio de borosilicato, espuma o plástico y tienen la abertura tapada con corcho o plástico de polietileno. Los frascos al vacío se utilizan a menudo como contenedores de transporte aislados.
Los matraces al vacío extremadamente grandes o largos a veces no pueden sostener completamente el matraz interior desde el cuello solamente, por lo que se proporciona un apoyo adicional mediante espaciadores entre el revestimiento interior y exterior. Estos espaciadores actúan como un puente térmico y reducen parcialmente las propiedades aislantes del matraz alrededor de la zona donde el espaciador entra en contacto con la superficie interior.
Varias aplicaciones tecnológicas, como las máquinas de RMN y resonancia magnética, dependen del uso de matraces de doble vacío. Estos matraces tienen dos secciones de vacío. El matraz interior contiene helio líquido y el matraz exterior contiene nitrógeno líquido, con una sección de vacío en medio. La pérdida del preciado helio está limitada de esta manera.
Otras mejoras del matraz al vacío incluyen el escudo contra la radiación refrigerado por vapor y el cuello refrigerado por vapor, ambos ayudan a reducir la evaporación del matraz.
Para más información «James Dewar, the man who invented the thermos flask»
Como citar este artículo:
APA: (2019-06-24). Frasco de Dewar. Recuperado de https://quimicafacil.net/infografias/material-de-laboratorio/frasco-de-dewar/
ACS: . Frasco de Dewar. https://quimicafacil.net/infografias/material-de-laboratorio/frasco-de-dewar/. Fecha de consulta 2026-01-27.
IEEE: , "Frasco de Dewar," https://quimicafacil.net/infografias/material-de-laboratorio/frasco-de-dewar/, fecha de consulta 2026-01-27.
Vancouver: . Frasco de Dewar. [Internet]. 2019-06-24 [citado 2026-01-27]. Disponible en: https://quimicafacil.net/infografias/material-de-laboratorio/frasco-de-dewar/.
MLA: . "Frasco de Dewar." https://quimicafacil.net/infografias/material-de-laboratorio/frasco-de-dewar/. 2019-06-24. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net