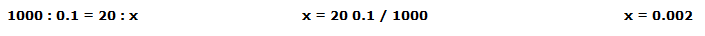Actualizado en enero 8, 2024
Tiempo de lectura estimado: 5 minutos
El jugo o zumo de limón es el líquido obtenido del endocarpio de los limones al ser exprimido (generalmente con un exprimidor de cítricos). Dicho líquido suele representar un 30% del peso del fruto.
Su sabor ácido característico es proporcionado por el ácido cítrico (encontrado también en otros jugos de frutas) en una concentración del 5% al 6%; sin embargo, la proporción de este cambia según la variedad y cultivo del limón. La esencia del limón es debida al limoneno y está presente en grandes concentraciones en la piel externa del limón.
La presencia de estos ácidos provoca en el paladar una reacción de ‘defensa’ aumentando la salivación para que los ácidos se disuelvan y disminuyan su efecto nocivo sobre el epitelio bucal.
La cantidad de ácido presente en un zumo de limón o de lima se suele medir en la industria de alimentación encargada de procesar estos jugos con instrumentos denominados refractómetros (medido a 20 °C), en los que se calibra el índice de refracción del zumo con su contenido de ácidos. La acidez del zumo de limón se fija en un pH de 2.3
Materiales
- 1 bureta de 50 mL
- Filtros de papel
- Pipeta volumétrica de 2 mL o pipeta graduada
- Erlenmeyers de 100 y 250 mL
- Vaso de precipitados de 100 mL
Reactivos
- Limón
- Hidróxido de sodio sol. 0,1 M
- Fenolftaleína sol. 1%.
Procedimiento
Determinación de la acidez del zumo de limón
Exprimir un limón o más completamente en un vaso de precipitados de 100 mL para obtener mínimo 10 mL de zumo. Filtrar el zumo con un filtro de papel rápido (por ejemplo, filtro Wathman 113 o 91), tomar 2 mL de este, con una pipeta calibrada o graduada, vertiéndolos en un matraz Erlenmeyer de 250 mL; añadir unos 100 mL de agua destilada y 3 o 4 gotas de fenolftaleína sol. 1% como indicador; la solución queda, obviamente, incolora.
Llenar el matraz con 50 mL de solución de hidróxido de sodio 0,1 M y hacer un montaje de titulación, colocar el matraz bajo la llave de paso y proceder a la valoración, goteando lentamente el valorante y agitando el matraz.
Cuando el indicador se vuelva rosa-violeta, cerrar la llave de paso y anotar la cantidad de hidróxido de sodio sol. 0,1 M consumida.
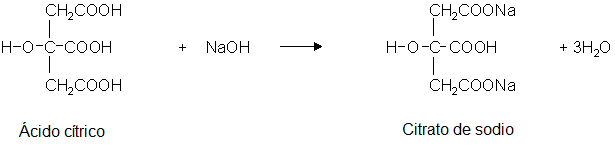
En este punto todo el ácido cítrico presente en el zumo de limón ha sido neutralizado por el hidróxido de sodio con la reacción:
Como se puede ver, para neutralizar un mol de ácido cítrico, un hidroxiácido tricarboxílico alifático, necesitas 3 moles de hidróxido de sodio, por lo que el número de moles presentes en la cantidad de hidróxido de sodio goteada es 3 veces el número de moles de ácido cítrico presentes en los 2 mL de zumo de limón.
Repetir la medición al menos por triplicado (3 veces) y anotar los valores.
Después del experimento
Realizar los cálculos como sigue.
Utilizamos 20 mL de sol. de NaOH 0,1 M para valorar 2 mL de zumo de limón; calculamos los moles presentes:
Con la fórmula: nmoles = M * VL tenemos:
nmoles = 0.1 * 0.02 entonces, nmoles = 0.002
o, con la relación V1:M1 = V2:Mx tenemos:
El valor obtenido corresponde al número de moles presentes en 20 mL de hidróxido de sodio 0,1 M, por lo que el número de moles de ácido cítrico presentes en 2 mL de zumo de limón es 1/3 de este valor, es decir, nmol = 0,00066.
A partir de este valor se puede calcular la concentración molar de ácido cítrico en el zumo de limón mediante la proporción:
El zumo de limón es, por tanto, una solución 0,33 M de ácido cítrico.
Es posible, entonces, transformar el valor molar en concentración g/L multiplicando el número de moles por la masa molecular relativa del ácido cítrico (= 192,13):
o alrededor del 6 %.
De hecho, el zumo de limón contiene aproximadamente un 6 % de ácido cítrico y tiene una concentración hidrogeniónica de aproximadamente 2*10-3 M, lo que da lugar a un pH = 2,8.
Para más información Sourness & Scurvy – The Chemistry of a Lemon
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Como citar este artículo:
APA: (2021-02-17). Determinación de la acidez del zumo de limón. Recuperado de https://quimicafacil.net/manual-de-laboratorio/q-general-basica/determinacion-de-la-acidez-del-zumo-de-limon/
ACS: . Determinación de la acidez del zumo de limón. https://quimicafacil.net/manual-de-laboratorio/q-general-basica/determinacion-de-la-acidez-del-zumo-de-limon/. Fecha de consulta 2024-07-27.
IEEE: , "Determinación de la acidez del zumo de limón," https://quimicafacil.net/manual-de-laboratorio/q-general-basica/determinacion-de-la-acidez-del-zumo-de-limon/, fecha de consulta 2024-07-27.
Vancouver: . Determinación de la acidez del zumo de limón. [Internet]. 2021-02-17 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/q-general-basica/determinacion-de-la-acidez-del-zumo-de-limon/.
MLA: . "Determinación de la acidez del zumo de limón." https://quimicafacil.net/manual-de-laboratorio/q-general-basica/determinacion-de-la-acidez-del-zumo-de-limon/. 2021-02-17. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net