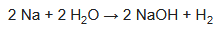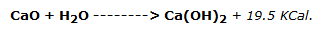Actualizado en junio 26, 2023
Tiempo de lectura estimado: 5 minutos
El hidróxido de sodio, también conocido como lejía y sosa cáustica, es un compuesto inorgánico de fórmula NaOH. Es un compuesto iónico sólido de color blanco formado por cationes sodio Na+ y aniones hidróxido OH–.
El hidróxido de sodio es una base altamente cáustica y un álcali que descompone las proteínas a temperaturas ambientales ordinarias y puede causar graves quemaduras químicas. Es muy soluble en agua y absorbe fácilmente la humedad y el dióxido de carbono del aire. Forma una serie de hidratos NaOH-nH2O. El monohidrato NaOH-H2O cristaliza en soluciones acuosas entre 12,3 y 61,8 °C. El «hidróxido de sodio» disponible en el mercado suele ser este monohidrato, y los datos publicados pueden referirse a él en lugar del compuesto anhidro.
Como uno de los hidróxidos más simples, el hidróxido de sodio se utiliza con frecuencia junto con el agua neutra y el ácido clorhídrico para demostrar la escala de pH a los estudiantes de química.
El hidróxido de sodio se utiliza en muchas industrias: en la fabricación de pasta y papel, textiles, agua potable, jabones y detergentes, y como limpiador de desagües.
Preparación del hidróxido de sodio por la caustificación de carbonatos
Históricamente, el hidróxido de sodio se producía tratando el carbonato de sodio con el hidróxido de calcio en una reacción de metátesis que aprovecha el hecho de que el hidróxido de sodio es soluble, mientras que el carbonato de calcio no lo es. Este proceso se denominaba caustificación.
Este proceso fue sustituido por el proceso Solvay a finales del siglo XIX, que a su vez fue suplantado por el proceso cloroalcalino que utilizamos hoy en día.
El hidróxido de sodio también se produce combinando sodio metálico puro con agua. Los subproductos son el gas hidrógeno y el calor, que a menudo da lugar a una llama.
Esta reacción se utiliza comúnmente para demostrar la reactividad de los metales alcalinos en entornos académicos; sin embargo, no es comercialmente viable, ya que el aislamiento del metal sodio se realiza típicamente por reducción o electrólisis de compuestos de sodio, incluyendo el hidróxido de sodio.
Materiales
- Papel indicador universal
- Alambre de níquel-cromo
- Secador
- Capsula de porcelana grande
- Varilla de vidrio
- Vaso de precipitados de 250 mL
- Probeta de 250 mL
- Embudo de vidrio sinterizado
Reactivos
- Carbonato sódico cristalino
- Óxido de calcio
Preparación
Se basa en una reacción de doble intercambio, denominada «caustificación de carbonatos»:
Vierta 10 g de óxido de calcio en polvo en un plato de porcelana y añada suficiente agua destilada para formar una «leche de cal» (Ca(OH)2) bastante densa.
La reacción es:
Hay que tener en cuenta que esta reacción es exotérmica y, por tanto, desarrolla un calor que podría romper un recipiente inadecuado; por este motivo, la operación se realiza en una cápsula de porcelana.
Toma un vaso de precipitados de 250 mL, vierte en él unos 100 mL de agua destilada, colócalo en el mechero Bunsen, sobre una malla de amianto o de vidrio para calentamiento, y caliéntalo hasta casi el punto de ebullición. Verter en el agua caliente 20 g de carbonato sódico cristalino, removiendo y calentando hasta su completa disolución.
A continuación, vierta la «leche de cal» en el vaso de precipitados, continuando el calentamiento y la agitación con una varilla de vidrio durante al menos 10 minutos.
Pasado este tiempo, apaga el mechero Bunsen y deja que el vaso de precipitados se enfríe con su contenido. El carbonato de calcio insoluble (CaCO3) formado por la reacción precipitará, mientras que el sobrenadante será una solución de hidróxido de sodio (NaOH).
Esta fracción se recoge por decantación o filtración con un embudo filtrante o con lana de vidrio (¡¡no con filtros de papel!!) y, humedeciendo una varilla de vidrio, se toca un mapa al indicador universal para verificar la situación de alta basicidad.
Se puede hacer evaporar la solución, calentándola aún más y colocándola en un desecador para recoger el hidróxido de sodio cristalino que, en un paso posterior, puede someterse a una prueba a la llama para evidenciar la presencia del ion Na+ (coloración amarilla).
Después del laboratorio
A partir de las reacciones empleadas en el laboratorio, hacer los cálculos estequiométricos para obtener la cantidad necesaria de hidróxido de sodio para preparar un litro de solución 1M asumiendo exceso de los demás reactivos excepto el carbonato de sodio.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Causticising reaction kinetics
Como citar este artículo:
APA: (2022-01-12). Preparación del hidróxido de sodio por caustificación. Recuperado de https://quimicafacil.net/manual-de-laboratorio/preparacion-del-hidroxido-de-sodio-por-caustificacion/
ACS: . Preparación del hidróxido de sodio por caustificación. https://quimicafacil.net/manual-de-laboratorio/preparacion-del-hidroxido-de-sodio-por-caustificacion/. Fecha de consulta 2024-07-27.
IEEE: , "Preparación del hidróxido de sodio por caustificación," https://quimicafacil.net/manual-de-laboratorio/preparacion-del-hidroxido-de-sodio-por-caustificacion/, fecha de consulta 2024-07-27.
Vancouver: . Preparación del hidróxido de sodio por caustificación. [Internet]. 2022-01-12 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/preparacion-del-hidroxido-de-sodio-por-caustificacion/.
MLA: . "Preparación del hidróxido de sodio por caustificación." https://quimicafacil.net/manual-de-laboratorio/preparacion-del-hidroxido-de-sodio-por-caustificacion/. 2022-01-12. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net