Actualizado en agosto 29, 2021
Tiempo de lectura estimado: 4 minutos
La fusión y solidificación son fenómenos que dan información valiosa sobre las propiedades y características de la materia. El punto de fusión (o solidificación) es una característica propia de una sustancia pura y pueden emplearse para su identificación.
En termodinámica, un cambio de estado es una transición de fase en la transición de un estado de la materia a otro. Los tres estados principales de la materia son: sólido, líquido y gaseoso, pero hay otros estados menos comunes: plasma, fluido supercrítico entre otros.
El cambio de estado de un cuerpo puro es causado por un cambio en su presión, temperatura y/o volumen.
Es posible representar estados y cambios de estado en un diagrama de fase tridimensional (P, V, T); al proyectar este diagrama en diferentes planos, se obtienen los diagramas bidimensionales (P, T) y (P, V).
El punto triple es un punto en el diagrama de fase que corresponde a la coexistencia de tres estados sólido, líquido y gaseoso de un cuerpo puro. Es único y se define por una temperatura y presión determinadas.
Materiales
- Vaso de precipitados de 800 mL
- Tubo de ensayo pequeño
- Varilla de agitación
- Termómetro de 0 – 100 °C, con divisiones de 0.1 °C
- Mechero Bunsen
- Cronometro
- Soporte universal
- Pinzas para soporte universal
- Trípode
- Malla o soporte de calentamiento
Reactivos
- Tiosulfato de sodio
Procedimiento
El objetivo de la experiencia es el estudio analítico de la fusión y solidificación de una sustancia y la graficación de los resultados obtenidos. El tiosulfato de sodio (Na2S2O3 ∙ 5H2O) se utiliza por su bajo punto de fusión, 47,5 °C.
Parte 1: Fusión
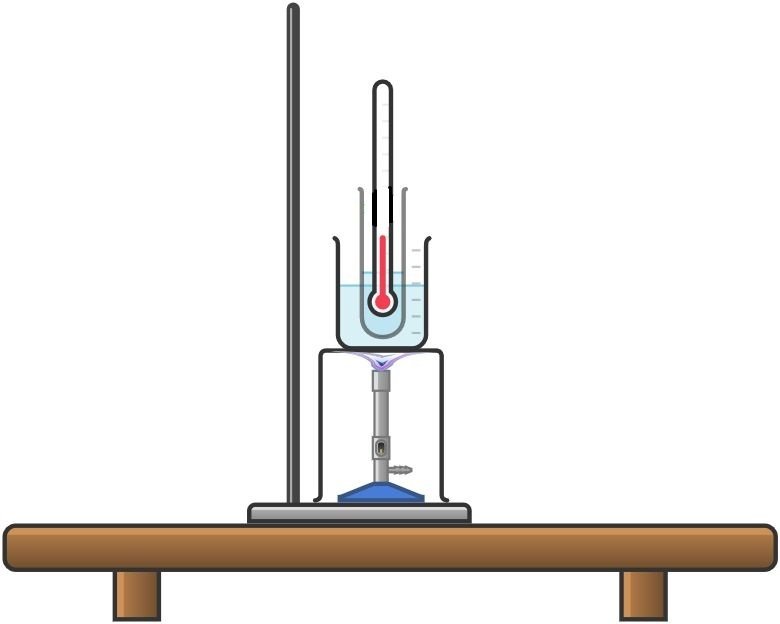
Se llena un tubo de ensayo pequeño por la mitad con tiosulfato de sodio y se sumerge completamente el bulbo del termómetro en la sal; se fija el termómetro con un soporte, de manera que el bulbo no pueda tocar las paredes del tubo, se sumerge en un vaso de 800 mL lleno de agua, suspendiéndolo con otro soporte adecuado. Poner todo en un trípode con una placa de calentamiento colocada sobre un mechero Bunsen, encenderlo a fuego lento, llevando la sal a una temperatura de 40 °C. Una vez que se alcanza este valor, se pone en marcha el cronómetro, se agita el agua constantemente con una varilla de agitación y se mide la temperatura a intervalos de 30 segundos, anotándolo los valores. A una temperatura de 60 °C, el quemador Bunsen se apaga y se lleva a cabo la segunda parte de la experiencia.
Segunda parte: solidificación
Proceda exactamente como en la primera parte, iniciando el cronómetro cuando el termómetro indique que el tiosulfato fundido tiene una temperatura de 60 °C, y tomando mediciones cada 30 segundos, hasta que la masa salina haya alcanzado una temperatura de unos 30-35 °C. Estos valores también se anotan.
Después del experimento
Graficación de los resultados
Se toman los resultados de la experiencia de fusión y se grafican en las abscisas de un gráfico cartesiano los valores del tiempo transcurrido y en las ordenadas los valores de las temperaturas alcanzadas por la sal.
Se observa que en el gráfico la temperatura aumenta rápidamente, pero tiene un tope, con aplanamiento del gráfico, en correspondencia con el valor de 47,5 °C aproximadamente; en este punto, de hecho, mientras se sigue administrando calor, la temperatura permanece constante. De hecho, los estados sólido y líquido siguen coexistiendo y la energía suministrada sirve para romper las fuerzas que forman la red cristalina de la sal; esta parte del gráfico corresponde a la pausa térmica. Tan pronto como todo el tiosulfato de sodio se ha licuado, la temperatura comienza a subir de nuevo y con ella la curva del gráfico.
Finalmente, tomamos los valores de la experiencia de solidificación y los tratamos de igual manera; el gráfico resultante es exactamente el opuesto del anterior, o mejor, es la imagen en espejo; también este gráfico muestra, al valor de 47,5 °C, el reposo térmico durante el cual la energía térmica liberada por la sal fundida sirve para reorganizar la red cristalina.
Nota: para que la experiencia tenga éxito es necesario que el termómetro, el tubo de ensayo y el vaso de precipitados estén asegurados de tal manera que no entren en contacto directo, que el calentamiento sea lento y constante y que las lecturas sean oportunas y precisas. Se puede usar una placa calefactora eléctrica en lugar del mechero Bunsen.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Studio della fusione e della solidificazione di una sostanza
Como citar este artículo:
APA: (2020-09-16). Estudio de la fusión y solidificación de una sustancia. Recuperado de https://quimicafacil.net/manual-de-laboratorio/estudio-de-la-fusion-y-solidificacion-de-una-sustancia/
ACS: . Estudio de la fusión y solidificación de una sustancia. https://quimicafacil.net/manual-de-laboratorio/estudio-de-la-fusion-y-solidificacion-de-una-sustancia/. Fecha de consulta 2024-07-27.
IEEE: , "Estudio de la fusión y solidificación de una sustancia," https://quimicafacil.net/manual-de-laboratorio/estudio-de-la-fusion-y-solidificacion-de-una-sustancia/, fecha de consulta 2024-07-27.
Vancouver: . Estudio de la fusión y solidificación de una sustancia. [Internet]. 2020-09-16 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/estudio-de-la-fusion-y-solidificacion-de-una-sustancia/.
MLA: . "Estudio de la fusión y solidificación de una sustancia." https://quimicafacil.net/manual-de-laboratorio/estudio-de-la-fusion-y-solidificacion-de-una-sustancia/. 2020-09-16. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net