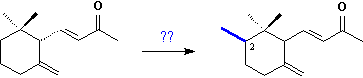Actualizado en junio 26, 2023
Tiempo de lectura estimado: 14 minutos
Las ironas son responsables de la fragancia violeta del precioso aceite de lirio, a su vez que son los principales componentes de su aroma. Las ironas, para ser moléculas tan pequeñas, han tenido una historia excepcionalmente larga y espinosa

La iris pallida y, con menos frecuencia, la I. germanica se cultivan comercialmente en algunas zonas de Italia, Francia y Marruecos para la producción de un aceite esencial utilizado en perfumería. Después de la cosecha y el secado al sol, los rizomas adquieren un agradable aroma a violeta que aumenta con el tiempo. El aceite que se obtiene generalmente por destilación al vapor da lugar a las diferentes mezclas de «essence d’iris» o «orris root oil» que son ingredientes bastante preciosos de los perfumes y otros cosméticos (ejemplos de perfumes comerciales con notas base de iris y orris*).

El principio odorífero fue aislado por primera vez por Tiemann y Krüger en 1893 y llamado «irona». Suponiendo que la fragancia de la violeta dulce (hace unos cien años, el aceite de flor de violeta era uno de los materiales de perfumería más valiosos) se debía al mismo producto natural, Tiemann y Krüger utilizaron el aceite de raíz de orris, de olor similar pero mucho más barato (Iris pallida Lam., fam. Iridaceae) en su búsqueda del principio odorífero de las violetas.

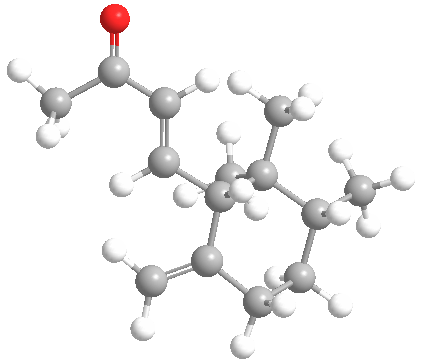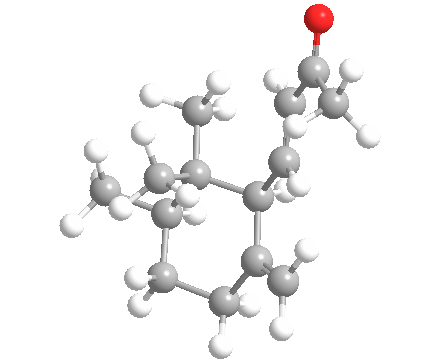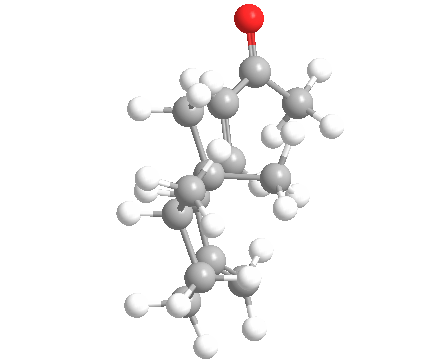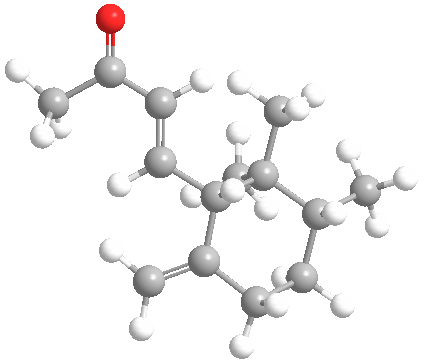
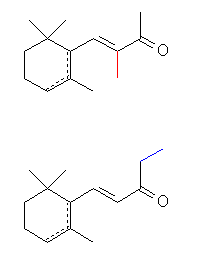
En una investigación fascinante y – considerando el poco sofisticado estado de la técnica en ese momento – brillantemente, concluyeron a partir de varias reacciones y por comparación con la α-ionona (1a), sintetizada por primera vez durante este estudio, que la estructura del irona era (1b).
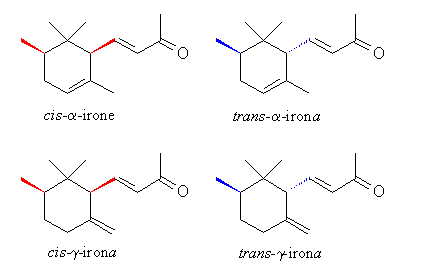
La estructura correcta de los ironas se estableció sólo 54 años más tarde y la estereoquímica fue dilucidada ya en 1971. En cuanto al olor, la cis-α-irona y la cis-γ-irona con su intenso y muy fino carácter de orris son los isómeros de irona más importantes del aceite de raíz de orris.
Sin embargo, en 1972 un análisis en profundidad del aceite de flor de violeta mostró que una mezcla de α- y β- ionona era de hecho responsable del olor de las violetas. Aunque Tiemann y Krüger habían analizado incorrectamente el aceite de raíz de orris en busca del principio oloroso de las violetas, en realidad habían descubierto lo que buscaban inicialmente.
Relaciones estructura – olor en las ironas
La similitud entre los olores surge porque sustancias o mezclas de compuestos similares pueden interactuar con los receptores para crear impresiones sensoriales similares en los centros sensoriales del cerebro. El grupo de fragancias de almizcle (que comprende cetonas y ésteres macrocíclicos, así como compuestos nitro aromáticos y derivados del isocromano) son, por ejemplo, compuestos con olores similares, pero con estructuras totalmente diferentes.
Sin embargo, pequeños cambios de estructura (por ejemplo, la introducción de uno o más dobles enlaces en los alcoholes o aldehídos alifáticos) pueden, después de una impresión sensorial, intensificar un olor en varios órdenes de magnitud.
El conocimiento cada vez mayor de la estructura y el funcionamiento de los receptores olfativos puede proporcionar una mejor base científica para la correlación del olor y la estructura en las sustancias de fragancia y sabor, y facilitar la predicción más exacta del olor de compuestos aún desconocidos.
1. Regioselectividad de la percepción de olores
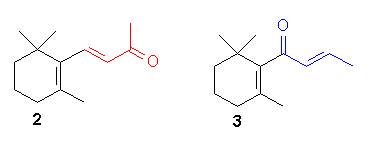
Usando un modelo apropiado, la dependencia de las propiedades de olor de un compuesto orgánico en las modificaciones estructurales puede ser fácilmente demostrada. En el caso más simple se puede afectar un cambio de olor en un odorante cambiando el entorno molecular del grupo funcional.
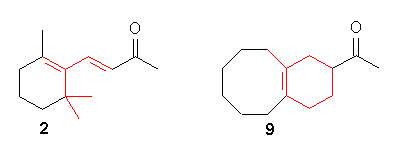
Una simple transposición de la función alilo en un odorante puede conducir a cambios drásticos en la calidad del olor. Un buen ejemplo en la β–ionona (2) cuyo olor después de la transposición a la «rosecetona» (3) cambia del típico carácter violeta a un olor complejo con tonalidades muy afrutadas, alcanforadas y verdes.
2. Estereoquímica y olor
Influencia de los sustituyentes: Los grupos funcionales juegan un papel determinante en la fuerza y el carácter de los odorantes. Se considera que la fuerza motriz del evento del receptor de olor es una interacción dirigida dipolo-dipolo.
α-isometilionona: que recuerda al orris y a las violetas, posee el más fino olor de todas las iononas.
β–isometilionona: interesante, polvoriento, parecido al orris con aspectos leñosos.
α-n-metilionona : recuerda a la α-ionona, pero más suave y delicada.
β–n-metilionona : parecido a la β–ionona, pero con una nota distintiva de cuero.
(cada par corresponde a una de las imágenes al lado izquierdo)
α-, γ- ironas, en el sentido de que un grupo metilo está en el anillo son sustancias notables que poseen un poderoso y muy agradable olor a violeta muy superior a cualquier ionón y metionona.
Geometría de compuestos insaturados: Los odorantes (E, Z) isoméricos generalmente exhiben diferentes perfiles sensoriales. Hay una diferencia remanente en el carácter del olor entre el odorante violeta artificial (E)-8-metil-α-ionona (4) y su agradable y leñoso isómero (Z)-isómero (5) similar al del tabaco.
Aparentemente las diferentes formas de la molécula determinan la calidad del olor, porque el análogo bicíclico (6) tiene un olor muy similar al monocíclico (5).
Diastereoselectividad: Pequeños cambios en la estructura molecular de un estímulo pueden conducir a cambios drásticos en las propiedades cualitativas del olor de un odorante.
Desde el punto de vista de la calidad del aroma, la cis-α-irona tiene un olor a aceite de iris limpio, mientras que la trans-α-irona diasteromérica es menos apreciada.
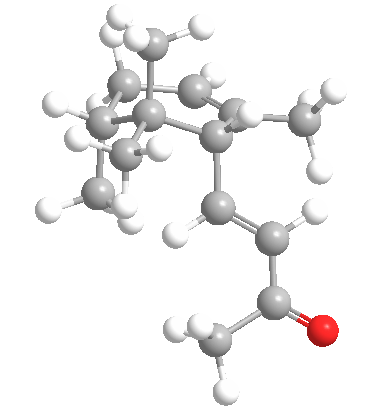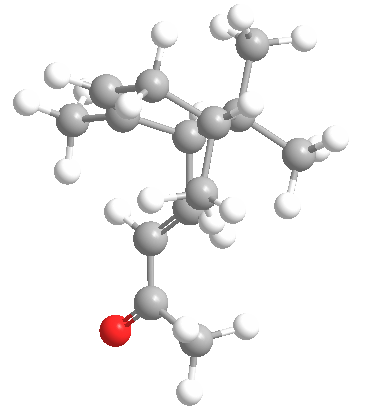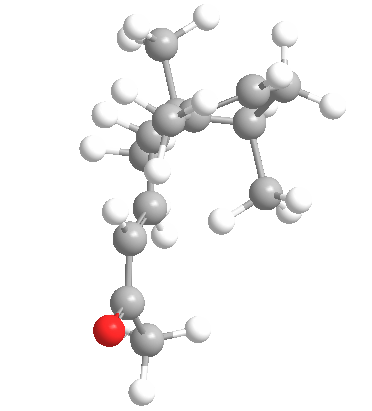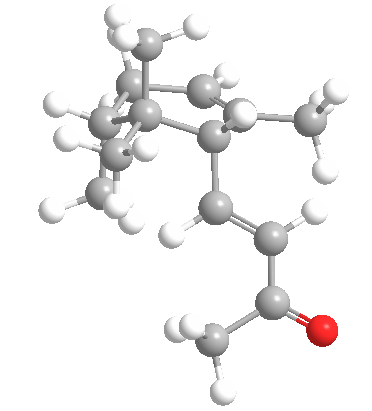
la cis-γ-irona posee un poderoso y muy agradable olor a violeta muy superior al del trans-irona.
3. QSAR (Quantitative-Structure-Activity-Relationships – Relaciones cuantitativas-estructurα-actividad)
Utilizando los parámetros de conectividad como descriptores selectivos, los estudios QSAR se hicieron con varios tipos de odorantes como el olor a sudor de los ácidos grasos, y compuestos que están estructuralmente relacionados con el benzaldehído. El hecho de que los dos «olores primarios» de Amoore, como el etéreo y el floral, también pudieran correlacionarse con un compuesto estándar correspondiente reduce el valor de este procedimiento de correlación. Lamentablemente, se desconocen los incrementos de conectividad tridimensional.
Los métodos que sólo utilizan datos físico-químicos, así como los enfoques topológicos que sólo utilizan dos dimensiones, no son adecuados para los estudios olfativos. Un método estadístico basado en la identificación asistida por computadora de las partes activas sensoriales de una molécula para el cálculo de las relaciones estructura/actividad (SAR) mostró grandes resultados. El valor de este análisis de reconocimiento de patrones depende del número y la calidad de los descriptores seleccionados.
La modelización molecular asistida por ordenador trata las propiedades moleculares de un compuesto activo en tres dimensiones. Hoy en día, se puede utilizar una serie de programas disponibles en el mercado para los gráficos moleculares asistidos por ordenador. La industria farmacéutica también utiliza programas patentados hechos a medida para este propósito.
La superposición de compuestos modificados estructuralmente con moléculas activas no sólo permite la identificación de las partes estructurales osmóforas sino que también puede, de forma limitada, llevar a la predicción de nuevos odorantes que posean propiedades similares al compuesto con el que se ha superpuesto.
El primer odorante hecho a medida que fue conceptualizado por la técnica de diseño molecular asistido por computadora fue el Koavone®7, que es un compuesto basado en los elementos estructurales activos sensoriales de la 8-metil-α-ionona8
El modelado molecular de la β–ionona (2) mostró que la masa estérica de la sustitución del dimetilo puede ser imitada mediante la fusión de un anillo de seis miembros. El grupo de 5-metilo restante se encontró entonces que se superponía mejor con una estructura de ciclooctano. La combinación de estas características estructurales dio origen a una cetona bicíclica (9).
La cetona bicíclica propuesta fue sintetizada y el olor frutal y leñoso del blanco molecular se encontró muy cercano al de la molécula padre β–ionona.
Origen de las ironas
A diferencia de las iononas que aparentemente están muy difundidos en la naturaleza, los ironas hasta ahora sólo se han encontrado en el aceite de raíz de orris y más recientemente en los extractos de musgo de roble.
Si observamos las características estructurales de los ironas en comparación con los ionones, su rara aparición no es muy sorprendente. Los ionones tienen un esqueleto terpenoide normal y se puede pensar que son productos de división oxidativa de los carotenoides, que de hecho a menudo son fuentes de estos compuestos. La estructura de las ironas, en cambio, no se ajusta a la regla del isopreno. En particular, el grupo metilo en el C(2) del anillo representa una característica que requiere una explicación. Sin embargo, la naturaleza terpenoide de los ironas está más allá de la duda. Nadie ha preguntado nunca cómo se originan los ironas en la planta, sino por un intento de encontrar carotenoides metilados en anillo en los extractos de rizoma que, sin embargo, fracasó.
Ciertamente las cetonas C14 no son los metabolitos secundarios originales de las plantas. Los productores de aceite de orris saben desde hace mucho tiempo que los rizomas recién cosechados no contienen ningún tipo de ironas y que el aroma se desarrolla gradualmente hasta alcanzar su máximo después de 3 a 4 años de almacenamiento de los rizomas pelados; sin embargo, la razón de este desarrollo – ya sea enzimático o por otros medios – ha permanecido oscura.
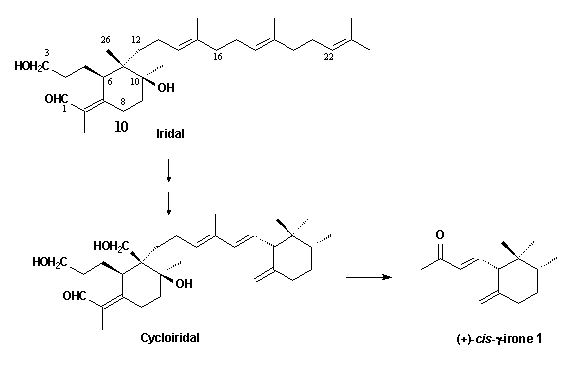
Estas cetonas C14 se derivan de la degradación oxidativa de los triterpenoides bicíclicos metilados, los cicloiridales, que se encuentran junto con los iridales monocíclicos (10) en las raíces y rizomas de varias especies de Iris.
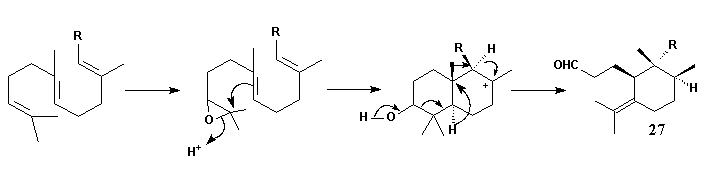
Un camino más probable para la formación del Iridal
La epoxidación del escualeno y la posterior ciclización conduce a un intermedio iónico bicíclico que se reorganiza de la manera que se muestra para formar el esqueleto de los triterpenoides de Iris. Por este esquema se puede explicar no sólo el inusual patrón de sustitución sino también la estereoquímica de los compuestos. C(1) y C(10) tienen que ser oxidados – este último con inversión de la configuración – y C(3) tiene que ser reducido para obtener el compuesto básico iridal.
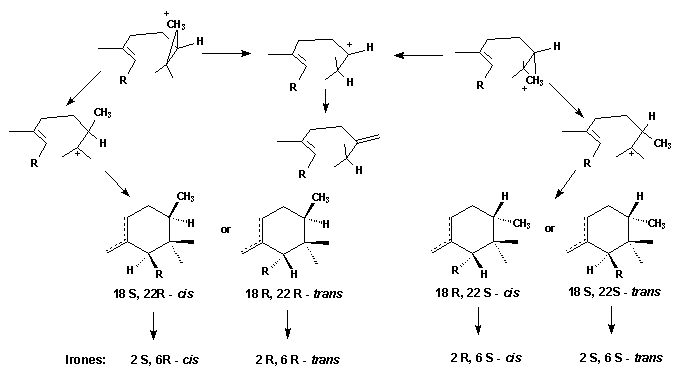
Por último, hay que responder a la pregunta planteada al principio: ¿cuándo y cómo se introdujo el grupo metilo extra en la posición no saturada C(22) de los iridales? Las ironas, biosintéticamente, se forma por la transferencia de un grupo Me, probablemente a través de la S-adenosilmetionina (SAM), al doble enlace terminal de un iridio de cadena abierta y la ciclización como se muestra en los experimentos de incorporación de la metionina marcada radioactivamente
El mecanismo más plausible para la adición sería aquel en el que se forma un catión de ciclopropano. La reacción de ciclización puede comenzar inmediatamente; alternativamente, el catión de ciclopropano puede abrirse para dejar la carga positiva en C(22) o C(23). El primero dará compuestos de cadena abierta de metileno en el carbono 22 como productos finales. El segundo, en cambio, dará lugar a los compuestos cíclicos. La estereoquímica en C(22) de los productos cíclicos probablemente depende únicamente del lado desde el cual la SAM ataca la molécula. El ataque desde arriba conduce a la molécula 22 R; el ataque desde abajo al isómero 22 S. Dependiendo de la dirección de la formación del anillo se formarán los productos 18 S- o 19 R.
Así se explica la formación de todos los posibles precursores de cis o trans-irona. La aparición simultánea de ambos 2 R, 6 S-cis y 2 S, 6 S-trans-ironas dentro del mismo aceite de iris implica, que la formación del catión ciclopropano no es estereoespecífica – aunque parece que se prefiere un producto. Sin embargo, la dirección del cierre del anillo y el giro de la cadena lateral R es unidireccional. Esto puede depender del «entorno» enzimático durante la ciclización, por ejemplo, la posición de una carga negativa estabilizadora o/y los efectos estéricos.
* La raíz de Orris (rhizoma iridis) es un término que se utiliza para las raíces de Iris germanica e Iris pallida. Tenía el nombre común de raíz de la Reina Isabel.
Para más información cis-(-)-gammα-Irone
Como citar este artículo:
APA: (2022-01-11). Ironas. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/ironas/
ACS: . Ironas. https://quimicafacil.net/compuesto-de-la-semana/ironas/. Fecha de consulta 2024-07-27.
IEEE: , "Ironas," https://quimicafacil.net/compuesto-de-la-semana/ironas/, fecha de consulta 2024-07-27.
Vancouver: . Ironas. [Internet]. 2022-01-11 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/ironas/.
MLA: . "Ironas." https://quimicafacil.net/compuesto-de-la-semana/ironas/. 2022-01-11. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net