Tiempo de lectura estimado: 13 minutos
La velocidad de reacción puede verse influenciada por diversos factores, aumentando o disminuyendo la velocidad. A continuación, se listan los factores más importantes.
Factores que afectan la velocidad de reacción
La naturaleza de los reactivos
La velocidad de reacción varía según las sustancias que reaccionan. Las reacciones ácido/base, la formación de sales y el intercambio de iones suelen ser reacciones rápidas. Cuando se produce la formación de enlaces covalentes entre las moléculas y cuando se forman grandes moléculas, las reacciones tienden a ser más lentas.
La naturaleza y la fuerza de los enlaces en las moléculas reactivas influyen en gran medida en la velocidad de su transformación en productos.
El estado físico
El estado físico (sólido, líquido o gas) de un reactivo es también un factor importante de la tasa de cambio. Cuando los reactantes están en la misma fase, como en la solución acuosa, el movimiento térmico los pone en contacto. Sin embargo, cuando están en fases separadas, la reacción se limita a la interfaz entre los reactantes. La reacción sólo puede ocurrir en su área de contacto; en el caso de un líquido y un gas, en la superficie del líquido. Puede ser necesario agitar y remover vigorosamente para completar la reacción.
Esto significa que cuanto más finamente dividido esté un reactivo sólido o líquido, mayor será su área de superficie por unidad de volumen y mayor será el contacto con el otro reactivo, por lo que la reacción será más rápida. Para hacer una analogía, por ejemplo, cuando se inicia un incendio, se utilizan astillas de madera y pequeñas ramas – no se comienza con grandes troncos de inmediato.
En la química orgánica, en el agua las reacciones son la excepción a la regla de que las reacciones homogéneas tienen lugar más rápidamente que las reacciones heterogéneas (son aquellas reacciones en las que el soluto y el disolvente no se mezclan adecuadamente)
Superficie de reacción en estado sólido
En un sólido, sólo las partículas que están en la superficie pueden participar en una reacción. Aplastar un sólido en partes más pequeñas significa que hay más partículas presentes en la superficie, y la frecuencia de las colisiones entre éstas y las partículas del reactivo aumenta, por lo que la reacción se produce más rápidamente. Por ejemplo, el Sherbet (polvo) es una mezcla de polvo muy fino de ácido málico (un ácido orgánico débil) y de carbonato de sodio.
Al entrar en contacto con la saliva en la boca, estos productos químicos se disuelven y reaccionan rápidamente, liberando dióxido de carbono y proporcionando la sensación de burbujas. Además, los fabricantes de fuegos artificiales modifican la superficie de los reactivos sólidos para controlar la velocidad de oxidación de los combustibles de los fuegos artificiales, utilizando esto para crear diversos efectos. Por ejemplo, el aluminio finamente dividido y confinado en una cáscara explota violentamente. Si se utilizan piezas más grandes de aluminio, la reacción es más lenta y se ven chispas al expulsar piezas de metal en llamas.
Concentración
Las reacciones se deben a colisiones de especies reactivas. La frecuencia con la que las moléculas o los iones colisionan depende de sus concentraciones. Cuanto más apiñadas estén las moléculas, más probable es que colisionen y reaccionen entre sí. Así pues, un aumento de las concentraciones de los reactivos dará lugar normalmente al correspondiente aumento de la velocidad de reacción, mientras que una disminución de las concentraciones tendrá normalmente un efecto inverso. Por ejemplo, la combustión se producirá más rápidamente en el oxígeno puro que en el aire (21% de oxígeno).
La ecuación de la tasa muestra la dependencia detallada de la tasa de reacción respecto de las concentraciones de reactivos y otras especies presentes. Las formas matemáticas dependen del mecanismo de reacción. La ecuación de la tasa real para una reacción determinada se determina experimentalmente y proporciona información sobre el mecanismo de reacción. La expresión matemática de la ecuación de la tasa viene dada a menudo por
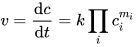
Aquí k es la constante de la velocidad de reacción, ci es la concentración molar del reactivo i y mi es el orden parcial de reacción para este reactivo. El orden parcial para un reactivo sólo puede determinarse experimentalmente y a menudo no está indicado por su coeficiente estequiométrico.
Temperatura
La temperatura suele tener un efecto importante en la velocidad de una reacción química. Las moléculas a mayor temperatura tienen más energía térmica. Aunque la frecuencia de las colisiones es mayor a temperaturas más altas, esto por sí solo contribuye sólo en una proporción muy pequeña al aumento de la velocidad de reacción.
Mucho más importante es el hecho de que la proporción de moléculas reactivas con suficiente energía para reaccionar (energía mayor que la energía de activación: E > Ea) es significativamente mayor y se explica en detalle por la distribución de las energías moleculares de Maxwell-Boltzmann.
El efecto de la temperatura en la constante de la tasa de reacción suele obedecer a la ecuación de Arrhenius

donde A es el factor pre-exponencial o factor A, Ea es la energía de activación, R es la constante molar del gas y T es la temperatura absoluta.
A una temperatura determinada, la velocidad química de una reacción depende del valor del factor A, la magnitud de la energía de activación y las concentraciones de los reactivos. Normalmente, las reacciones rápidas requieren energías de activación relativamente pequeñas.
La «regla empírica» de que la velocidad de las reacciones químicas se duplica por cada 10 °C de aumento de temperatura es un concepto erróneo común. Esto puede haberse generalizado a partir del caso especial de los sistemas biológicos, en los que el α (coeficiente de temperatura) suele estar entre 1,5 y 2,5.
La cinética de las reacciones rápidas puede estudiarse con el método del salto de temperatura. Esto supone utilizar un aumento brusco de la temperatura y observar el tiempo de relajación del retorno al equilibrio. Una forma particularmente útil de aparato de salto de temperatura es un tubo de choque, que puede aumentar rápidamente la temperatura de un gas en más de 1000 grados.
Catalizadores
Un catalizador es una sustancia que altera la velocidad de una reacción química pero que permanece químicamente inalterada después. El catalizador aumenta la velocidad de la reacción proporcionando un nuevo mecanismo de reacción que se produce con una menor energía de activación. En la autocatálisis, un producto de reacción es en sí mismo un catalizador para esa reacción que conduce a una retroalimentación positiva. Las proteínas que actúan como catalizadores en las reacciones bioquímicas se denominan enzimas. La cinética de Michaelis-Menten describe la velocidad de las reacciones mediadas por las enzimas. Un catalizador no afecta la posición del equilibrio, ya que el catalizador acelera las reacciones hacia atrás y hacia delante por igual.
En ciertas moléculas orgánicas, determinados sustitutos pueden influir en la velocidad de reacción en la participación de grupos vecinos
Presión
El aumento de la presión en una reacción gaseosa incrementará el número de colisiones entre los reactivos, aumentando la velocidad de reacción. Esto se debe a que la actividad de un gas es directamente proporcional a la presión parcial del gas. Esto es similar al efecto de aumentar la concentración de una solución.
Además de este simple efecto de acción de masa, los propios coeficientes de velocidad pueden cambiar debido a la presión. Los coeficientes de velocidad y los productos de muchas reacciones en fase gaseosa a alta temperatura cambian si se añade un gas inerte a la mezcla; las variaciones de este efecto se denominan caída y activación química.
Estos fenómenos se deben a reacciones exotérmicas o endotérmicas que ocurren más rápidamente que la transferencia de calor, lo que hace que las moléculas que reaccionan tengan distribuciones de energía no térmicas (distribución no Boltzmann). El aumento de la presión aumenta la tasa de transferencia de calor entre las moléculas que reaccionan y el resto del sistema, reduciendo este efecto.
Los coeficientes de la tasa de fase condensada también pueden verse afectados por la presión, aunque se requieren presiones bastante altas para que el efecto sea medible porque los iones y las moléculas no son muy comprimibles. Este efecto se estudia a menudo utilizando yunques de diamante.
La cinética de una reacción también puede estudiarse con un enfoque de salto de presión. Esto implica hacer cambios rápidos en la presión y observar el tiempo de relajación del retorno al equilibrio.
Absorción de la luz
La energía de activación para una reacción química puede proporcionarse cuando una molécula reactiva absorbe luz de una longitud de onda adecuada y es promovida a un estado de excitación. El estudio de las reacciones iniciadas por la luz es la fotoquímica, un ejemplo destacado es la fotosíntesis.
Materiales
- 8 vasos de precipitados de 100 ml
- 4 pipetas graduadas de 10 ml
- Propipetas o pipeteadores
- Cronometro
- 4 agitadores magnéticos
- Planchas de agitación
Reactivos
- Soluciones de:
- Permanganato de potasio 0.02 M
- Ácido oxálico 0.1 M
- Ácido sulfúrico 95 %
- Ácido clorhídrico 10 M
- Cloruro de manganeso cristalino
- Polvo de carbonato de calcio
- Trozos de mármol
Procedimiento
En cuatro vasos de precipitados de 100 mL, utilizando una pipeta, se deben colocar 10 mL de permanganato de potasio (KMnO4) sol.0,1 M; empleando otros cuatro vasos de precipitados, utilizando otra pipeta, se deben colocar 10 mL de ácido oxálico sol.0,1 M. En los vasos de la segunda serie, añada cuidadosamente 2 mL de ácido sulfúrico al 95 %. La reacción que se espera es:
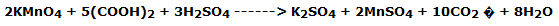
es decir, en términos de oxidación-reducción:
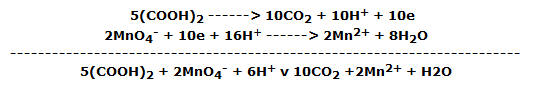
El carbono se oxida de +3 a +4, mientras que el manganeso se reduce de +7 a +2.
Nota: Para tener una agitación homogénea durante las distintas fases, si se dispone de ella, se recomienda el uso de un agitador magnético. Por lo tanto, sumergir en los 4 vasos que contienen la solución de permanganato de potasio 4 agitadores magnéticos para tenerlos listos en el momento de la reacción; al mismo tiempo, colocar el agitador magnético en la plancha de agitación. Si no se dispone del equipo, es posible proceder manualmente con el uso de una varilla de vidrio, aunque esto sea bastante aburrido.
Influencia de la concentración
Se toma uno de los vasos de precipitados que contienen ácido oxálico y ácido sulfúrico y se vierte en uno de los que contienen permanganato de potasio junto con un agitador magnético y se coloca en el agitador, iniciando un cronómetro. Cuando la decoloración se completa, se anota el tiempo de reacción, indicándolo con «T1».
Tome dos vasos, uno de cada serie y añada 10 mL de agua destilada a cada uno. Las dos soluciones se vuelven, por lo tanto, más diluidas, exactamente a 0,01 M de permanganato de potasio y a 0,05 M de ácido oxálico. Procedemos como en el primer experimento vertiendo el ácido oxálico y el ácido sulfúrico en el vaso de precipitados con el permanganato de potasio y el agitador magnético, colocando el sistema en el agitador y poniendo en marcha el cronómetro hasta la finalización de la reacción. El tiempo tomado se indica con «T2».

Se comparan los tiempos de las dos reacciones y se observa que T1 < T2; esto indica una influencia de las concentraciones de reactivos en la velocidad de reacción.
De hecho, las reacciones se producen cuando las partículas colisionan; cuanto mayor sea el número de colisiones en la unidad de tiempo, mayor será el número de partículas que se transforman; en consecuencia, la velocidad de reacción será mayor. En otras palabras, puede decirse que en una solución más concentrada cuanto mayor sea el número de partículas por unidad de volumen, mayor será el número de colisiones entre ellas en la unidad de tiempo y mayor la velocidad.
Guldberg y Waage establecieron que la velocidad de reacción es proporcional al producto de las concentraciones, expresadas en concentración molar, de las sustancias que reaccionan.
V = k [A][B] donde V = velocidad, k = constante de velocidad, A y B los reactivos.
La constante de velocidad tiene en cuenta factores que pueden influir en ella, como la naturaleza de los enlaces, la temperatura, la presencia de catalizadores; tiene un valor característico e igual para una determinada reacción en condiciones idénticas.
Influencia de la temperatura
Un vaso de la primera serie y uno de la segunda serie se calientan hasta una temperatura de unos 50 °C; se procede, entonces, de la manera habitual, anotando el tiempo de reacción, que será casi instantáneo, de modo que ni siquiera hay que poner el vaso en el agitador. El tiempo detectado se indica con «T3»; comparándolo con «T1» (concentraciones iguales de los reactivos) se observa que T3 < T1, que es una influencia considerable de la temperatura en la velocidad de reacción.
Como confirmación adicional de esto, se puede realizar un ensayo con las soluciones llevadas a una temperatura de unos 5/10 °C; en este caso, se observa un aumento del tiempo de reacción, que da como resultado T3 > T1.
Presencia de un catalizador
Se toman un par de vasos de precipitados y en el que contiene el ácido oxálico se disuelve una punta de espátula de cloruro de manganeso (MnCl2); se vierte el contenido en el vaso de precipitados con el permanganato en el que está sumergido el agitador magnético, se coloca en el agitador y se detecta el tiempo de reacción; esto se indica con «T4». Comparando este valor con el del primer experimento (concentraciones iguales de los reactivos e igual temperatura) se observa que T4 < T1 para demostrar la actividad de un catalizador positivo que favoreció la reacción.
Los catalizadores son sustancias capaces de influir en la velocidad de reacción sin participar directamente en ella. Se pueden clasificar en:
Catalizadores homogéneos: cuando están en el mismo estado físico que los reactivos.
Catalizadores heterogéneos: cuando se encuentran en un estado físico diferente al de los reactivos (por ejemplo, esponjas de platino en reacciones en solución).
Superficie de los reactivos
Se toma un trozo de mármol y sobre su superficie rugosa se gotea una solución de ácido clorhídrico; se observa una efervescencia debida al desarrollo de dióxido de carbono, según la reacción:
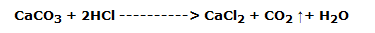
A continuación, se coloca una espátula de carbonato de calcio en polvo fino sobre un vidrio de reloj añadiendo unas gotas de ácido clorhídrico; se observa el desarrollo de dióxido de carbono, pero la reacción aparece mucho más rápidamente.
Esto significa que un área mayor de la superficie de reacción favorece su velocidad.
En general, las reacciones en las que los reactivos tienen que romper los enlaces covalentes y formar otros son lentas. Las reacciones entre los iones de cargas opuestas son rápidas, cuando no hay redox. Las reacciones entre los compuestos polares son medianas.
Nota: si se dispone de una solución de permanganato potásico 1 N, correspondiente a 0,2 M, puede diluirse en una proporción de 1:9 para obtener la solución requerida. Si se dispone de 1 N de ácido oxálico, correspondiente a 0,5 M, se puede diluir en una proporción de 2:8 para obtener la solución indicada.
Para más información Studio della velocità di reazione
Como citar este artículo:
APA: (2020-10-28). Factores que afectan la velocidad de reacción. Recuperado de https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/factores-que-afectan-la-velocidad-de-reaccion/
ACS: . Factores que afectan la velocidad de reacción. https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/factores-que-afectan-la-velocidad-de-reaccion/. Fecha de consulta 2025-07-05.
IEEE: , "Factores que afectan la velocidad de reacción," https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/factores-que-afectan-la-velocidad-de-reaccion/, fecha de consulta 2025-07-05.
Vancouver: . Factores que afectan la velocidad de reacción. [Internet]. 2020-10-28 [citado 2025-07-05]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/factores-que-afectan-la-velocidad-de-reaccion/.
MLA: . "Factores que afectan la velocidad de reacción." https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/factores-que-afectan-la-velocidad-de-reaccion/. 2020-10-28. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net