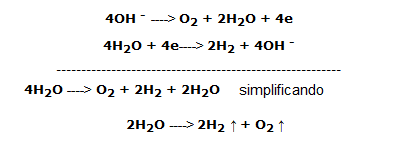Actualizado en enero 9, 2024
Tiempo de lectura estimado: 7 minutos

La electrólisis del agua se produce cuando hay un electrolito en el disolvente. El electrolito puede ser, como sabemos, un ácido disociado, una base o una sal. Por lo tanto, se pueden verificar las tres situaciones mencionadas en los experimentos.
Hay que recordar que el agua está formada principalmente por moléculas de H2O sin disociar y que sólo 1 molécula de cada 550 millones se disocia en iones H3O+ y OH– en condiciones normales.
Los iones H3O+ y OH– tienen, como es sabido, igual concentración molar y el producto (Kw) de estas concentraciones, a 25 °C, es = 1,00*10-14, de lo que se deduce que [H3O+] = 1,00*10 -7 mol/L y [OH–] = 1,00*10 -7 mol/L, mientras que [H2O] = 1000 g /18,016 g/mol = 55,5 mol/L.
Por estas razones, los iones H3O+ y OH– procedentes de la autoionización del agua pueden despreciarse a efectos de las reacciones electrolíticas.
Materiales
- Voltámetro de Hofmann con electrodos de platino
- Generador de corriente continua 6/12 voltios 0,5 A
- Soporte
- Cables.
Reactivos
- Ácido sulfúrico aprox. 5 %
- Sulfato de sodio aprox. 5 %
- Hidróxido de sodio aprox. 5 %
Procedimiento
Montaje de electrólisis del agua
Montar el voltámetro de Hofmann sobre su soporte, introduciendo los electrodos, montados sobre topes de goma, en los agujeros de los dos tubos laterales. Llena el aparato vertiendo la solución elegida por el orificio superior, dejando abiertos los grifos laterales; en cuanto el líquido alcance su nivel, ciérralos con cuidado.
Conecta los electrodos, mediante dos cables, al generador de corriente continua, indicando en el voltímetro cuál es el cátodo (-) y cuál el ánodo (+). Encienda el generador, observe el desarrollo del gas en los dos electrodos. Medir la altura relativa del gas obtenido en cada rama con la ayuda de una cinta métrica.
Parte 1: Electrólisis de una solución acuosa diluida de Na2SO4:
Se utiliza una solución de sulfato de sodio al 5% aproximadamente; antes de la electrólisis, están presentes en la solución moléculas dipolares de H2O, iones Na+ y SO4– procedentes de la disociación de la sal. Al provocar la electrólisis, se obtiene la migración de iones y moléculas, a saber
en el cátodo ( – ) migran los iones de carga positiva Na+ y las moléculas de H2O.
en el ánodo ( + ) migran los iones cargados negativamente, SO4–, y las moléculas de H2O.
Se producen las siguientes reacciones redox
En el cátodo se produce una reducción de las moléculas de H2O porque su potencial redox (E0(H2O/H2) = – 0,83 v) es mayor que el de Na+ (E0(Na+/ Na) = -2,71).
En el ánodo se produce la oxidación de las moléculas de H2O en virtud de que su potencial (E0(O2/H2O) = +1,23 v) es menor que el de SO4– (E0(SO42-/S2O82-) = +2,05 v ).
Las reacciones son:
Segunda parte: Electrólisis de una solución diluida de NaOH:
En este paso se utiliza una solución de hidróxido de sodio al 5 % aproximadamente. Antes de que se inicie la electrólisis, están presentes en la solución moléculas dipolares de H2O e iones OH– y Na+ procedentes de la disociación de la base. Al activar la reacción electrolítica se obtiene una migración de iones y moléculas, a saber:
en el cátodo ( – ) migran los iones de carga positiva Na+ y las moléculas de H2O.
los iones cargados negativamente, OH–, y las moléculas de H2O migran hacia el ánodo ( + ).
Se producen las siguientes reacciones de oxidación-reducción
En el cátodo se produce una reducción de las moléculas de H2O porque su potencial redox (E0(H2O/H2) = – 0,83 v) es mayor que el de Na+(E0(Na+/Na) = -2,71 ).
En el ánodo se produce la oxidación del OH– ya que su potencial (E0(O2/OH-) = + 0,40 v) es menor que el del H2O(E0(O2/H2O) = +1,23 v).
Las reacciones son:
Parte 3: Electrólisis de una solución diluida de H2SO4:
Se utiliza una solución de ácido sulfúrico al 5 % aproximadamente; antes de la electrólisis, están presentes en la solución moléculas dipolares de H2O, iones H3O+ y de la disociación del ácido. El desencadenamiento de la reacción electrolítica provoca la migración de iones y moléculas, es decir
en el cátodo ( – ) migran los iones cargados positivamente, las moléculas de H3O+ y H2O.
Los iones cargados negativamente SO4– y las moléculas de H2O migran hacia el ánodo ( + ).
Se producen las siguientes reacciones redox
En el cátodo se produce la reducción de los iones H3O+ porque su potencial redox (E0(H+/H2) = + 0,00 v) es mayor que el del H2O (E0(H2O/H2) = – 0,83 v).
En el ánodo se produce la oxidación de las moléculas de H2O en virtud de su potencial (E0(O2/H2O) = +1,23 v) menor que el de SO4– (E0(SO42-/S2O82-) = +2,05 v).
Las reacciones son:
Las reacciones electrolíticas pueden continuar hasta que haya agua en el voltímetro o hasta que las concentraciones de iones disociados de la sal, el ácido o la base aumenten demasiado.
Al final de cada fase se desconecta la alimentación y se observa que los gases en los dos tubos tienen una relación de volumen de hidrógeno/oxígeno 2:1, según la ley de Avogadro que dice «…. volúmenes iguales de diferentes gases, en las mismas condiciones de presión y temperatura, contienen el mismo número de moles … «.
Después del laboratorio
Con base a el volumen de gas recolectado en cada rama del voltámetro de Hoffman durante la electrólisis del agua, calcular la masa de agua separada por electrolisis en cada uno de los experimentos.
Para un espacio de tiempo predeterminado, ¿cuál de los experimentos genera mas volumen de cada gas? ¿Cuál es la razón?
Nota: este experimento puede realizarse en cursos medios o superiores de química en la universidad o en cursos de nivel básico a modo de demostración.
Para más información Electrolysis of Water Demonstration
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Como citar este artículo:
APA: (2021-05-26). Electrólisis del agua. Recuperado de https://quimicafacil.net/manual-de-laboratorio/electrolisis-del-agua/
ACS: . Electrólisis del agua. https://quimicafacil.net/manual-de-laboratorio/electrolisis-del-agua/. Fecha de consulta 2024-07-27.
IEEE: , "Electrólisis del agua," https://quimicafacil.net/manual-de-laboratorio/electrolisis-del-agua/, fecha de consulta 2024-07-27.
Vancouver: . Electrólisis del agua. [Internet]. 2021-05-26 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/electrolisis-del-agua/.
MLA: . "Electrólisis del agua." https://quimicafacil.net/manual-de-laboratorio/electrolisis-del-agua/. 2021-05-26. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net