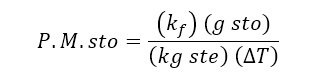Actualizado en noviembre 22, 2021
Tiempo de lectura estimado: 7 minutos
Las propiedades coligativas como el descenso del punto crioscópico dependen de la concentración del soluto disueltas y no del tipo de soluto disuelto en la solución.
Las propiedades coligativas son: aumento ebulloscópico (aumento del punto de ebullición), descenso crioscópico (disminución o depresión del punto de solidificación o congelación), presión osmótica y descenso de la presión de vapor.
El estudio y cuantificación de estas propiedades coligativas de las soluciones son de vital importancia en la ciencia y le ingeniería, encontrándose aplicaciones en diversos campos como alimentos, petroquímica, industria farmacéutica entre otros.
Descenso del punto crioscópico
La adición de un soluto a un solvente disminuye la temperatura de fusión de éste debido a diversos factores, como el impedimento de la formación de cristales de solvente, interacciones entre las moléculas de solvente y los iones de soluto e incluso la energía requerida para la disolución del soluto cuando se prepara la solución (calor de disolución).
Para un solvente especifico, la disminución del punto de fusión o descenso crioscópico es directamente proporcional a la concentración del soluto expresada en molalidad. En el caso del naftaleno, la relación existente entre el descenso de la temperatura de fusión y la molalidad de la solución es 6,9°C/molalidad, valor que corresponde a la llamada constante crioscópica (Kf).
La disminución del punto de fusión también se puede emplear para determinar la masa molecular (o peso molecular) de un soluto si se conocen ciertos datos del solvente. En este experimento se hallará la masa molecular del azufre (soluto) disuelto en naftaleno, que actuara como solvente, determinando la temperatura de fusión de una solución que contiene masas conocidas de ambos compuestos.
A partir del punto de fusión determinado y conociendo el punto de fusión del solvente puro y la constante crioscópica de éste, es posible determinar la masa molecular del soluto.
Definiendo el cambio en el punto de fusión como
Donde Tfp es la temperatura de fusión del solvente puro y Tf es la temperatura de fusión de la solución.
El cambio en el punto de fusión esta relacionada con la constante crioscópica kf y la concentración molal por la siguiente expresión.
Recordando que la molalidad se define como las moles de soluto dividido la masa de solvente expresada en kilogramos
Reemplazando las moles de soluto por la masa de soluto dividido en el peso molecular del mismo la expresión queda
Reordenando la expresión queda
Despejando el peso molecular del soluto
Materiales
- Tubo de ensayo grande
- Termómetro de laboratorio
- Pinzas
- Alambre de cobre*
- Mechero Bunsen
- Soporte universal
- Trípode o aro metálico
- Malla de calentamiento
- Beaker de 500 mL
- Balanza analítica
*El alambre de cobre se empleará como agitador en el tubo de ensayo, se puede reemplazar por una varilla de vidrio
Reactivos
- Naftaleno
- Azufre en polvo
Procedimiento
Tiempo necesario: 1 hora
Descenso del punto crioscópico
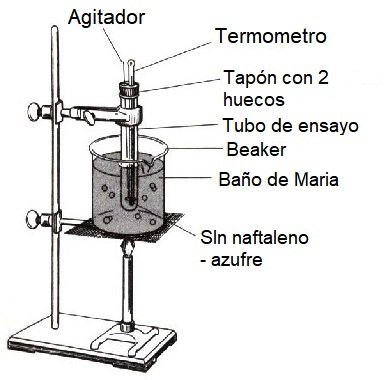
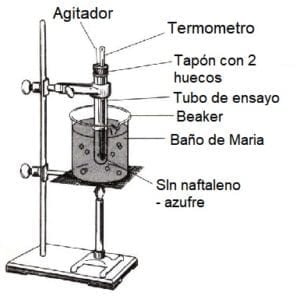
Realice el montaje como se indica en la figura. En la parte superior del tubo de ensayo se debe colocar un tapón con un hueco para el termómetro y otro para el agitador. El montaje también se puede realizar empleando una plancha de calentamiento en lugar del mechero como fuente de calor. La escala del termómetro debe quedar visible en el rango entre 100 y 70 °C.
 Anuncio
AnuncioPesar 5 g de naftaleno con una precisión de 0,1 g. Verter con sumo cuidado la masa de naftaleno en el tubo.
Colocar el tubo en un baño de agua caliente hasta que el naftaleno funda totalmente (observar que el nivel de agua quede por encima del nivel del naftaleno contenido en el interior del tubo).
Luego de observar la fusión, retirar el tubo del baño y dejar que el naftaleno se enfríe gradualmente, mientras se agita continuamente.
Leer la temperatura cada 15 segundos, comenzando alrededor de los 85°C. Observar el inicio de la cristalización y medir la temperatura a los intervalos preestablecidos, hasta que el naftaleno solidifique. Esta temperatura va a ser la temperatura de fusión del solvente puro.
AnuncioPesar 0,5 g de azufre finamente pulverizado. Calentar nuevamente a baño de maría el tubo de ensayo con el naftaleno hasta su fusión. Cuando el naftaleno este completamente fundido, verter todo el azufre en el naftaleno fundido. Agitar vigorosamente hasta que el azufre se haya disuelto.
Una vez lograda la disolución del azufre por completo, retirar el tubo del baño. Con agitación continua medir la temperatura, a partir de los 83°C, a intervalos de 15 segundos hasta que aparezcan los primeros cristales de naftaleno y la solución solidifique.
Calentar nuevamente al baño de maría el tubo de ensayo. Pesar 0,1 g de azufre en polvo y adicionar al tubo de ensayo, agitar hasta su disolución y repetir el anterior procedimiento. Realizar nuevamente adicionando 0,1 g de azufre más para recolectar datos.
Anuncio
Después del experimento
Realizar los cálculos correspondientes al peso molecular para cada conjunto de datos. Establecer un peso o masa molecular promedio con los datos obtenidos en cada toma de datos y comparar con el peso molecular reportado en la literatura. Calcular el porcentaje de error del valor obtenido en el experimento en comparación al reportado.
¿Qué factores pueden generar variación en los valores obtenidos experimentalmente en comparación a los reportados en literatura? Averigua que otras soluciones pueden ser estudiadas con el planteamiento experimental dado.
¿Cuales otras propiedades coligativas ademas del descenso del punto crioscópico se emplean en laboratorio e investigación para calcular o estimar una caracteristica de una sustancia ?
Limpieza
Para limpiar los instrumentos usados en la práctica se debe colocar el tubo de ensayo, termómetro y agitador en el baño de agua caliente nuevamente hasta lograr la fusión de la solución. Volcar la solución fundida sobre un papel. (No arrojar al desagüe)
Para eliminar los restos de solución adheridos al tubo, termómetro, etc., colocar éstos en un baño de agua a 90°C. No calentar directamente.
Proponer un procedimiento de laboratorio para determinar la constante crioscópica de una sustancia
Recomendaciones de seguridad
Tener cuidado con el agua caliente y evitar aspirar vapores de naftaleno y azufre. Manejar cuidadosamente el instrumental caliente para evitar quemaduras. En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la practica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Más información Experiment 3 Molecular Weight Determination from Freezing Point
Clasificación
Nivel: Universitario
Tipo: Practica de enseñanza
Riesgo: medio
Como citar este artículo:
APA: (2018-11-21). Propiedades coligativas – descenso del punto crioscópico. Recuperado de https://quimicafacil.net/manual-de-laboratorio/prop-coligativas-descenso-punto-crioscopico/
ACS: . Propiedades coligativas – descenso del punto crioscópico. https://quimicafacil.net/manual-de-laboratorio/prop-coligativas-descenso-punto-crioscopico/. Fecha de consulta 2024-07-27.
IEEE: , "Propiedades coligativas – descenso del punto crioscópico," https://quimicafacil.net/manual-de-laboratorio/prop-coligativas-descenso-punto-crioscopico/, fecha de consulta 2024-07-27.
Vancouver: . Propiedades coligativas – descenso del punto crioscópico. [Internet]. 2018-11-21 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/prop-coligativas-descenso-punto-crioscopico/.
MLA: . "Propiedades coligativas – descenso del punto crioscópico." https://quimicafacil.net/manual-de-laboratorio/prop-coligativas-descenso-punto-crioscopico/. 2018-11-21. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net