Actualizado en junio 26, 2023
Tiempo de lectura estimado: 5 minutos
La acetalización es la reacción orgánica que implica la formación de un acetal (o cetales). Una forma de formación de acetales es la adición nucleófila de un alcohol a una cetona o a un aldehído. La acetalización se utiliza a menudo en la síntesis orgánica para crear un grupo protector porque es una reacción reversible.
La acetalización es catalizada por el ácido con eliminación de agua; los acetales no se forman en condiciones básicas. La reacción puede conducirse al acetal cuando se elimina el agua del sistema de reacción, ya sea por destilación azeotrópica o atrapando el agua con tamices moleculares u óxido de aluminio.
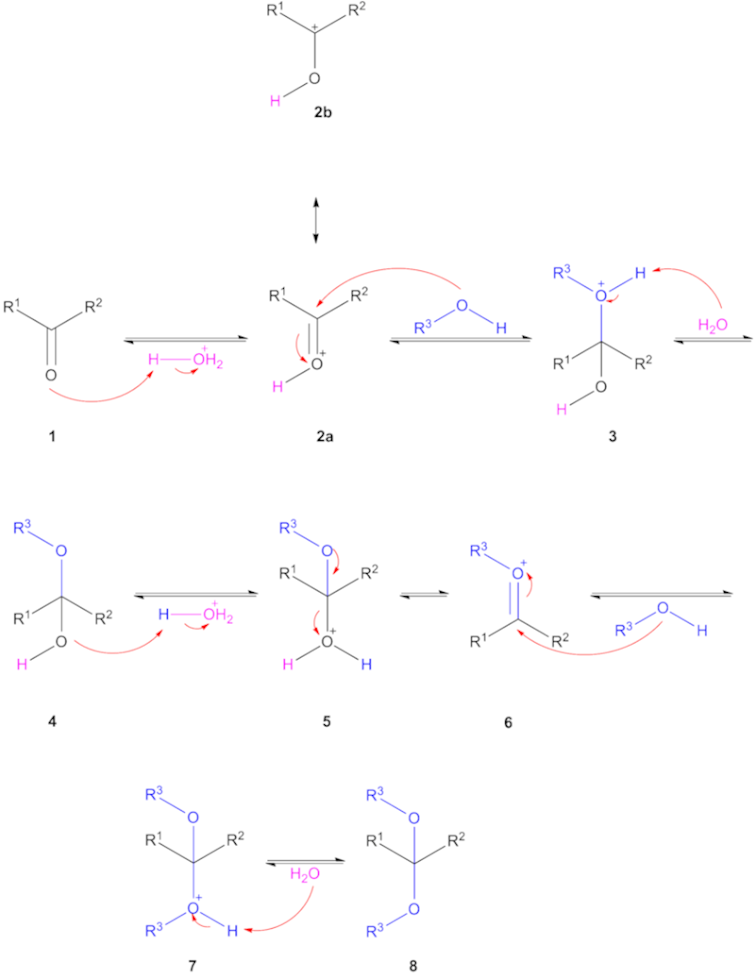
El grupo carbonilo de 1 toma un protón del hidronio. El grupo carbonilo protonado 2 se activa para la adición nucleofílica del alcohol. Las estructuras 2a y 2b son mesómeros. Tras la desprotonación de 3 por el agua se forma el hemiacetal o hemiketal 4. El grupo hidroxilo de 4 se protona dando lugar al ion oxonio 6 que acepta un segundo grupo alcohol a 7 con una desprotonación final al acetal 8. La reacción inversa tiene lugar añadiendo agua en el mismo medio ácido.
Los acetales son estables frente a los medios básicos. En una transacetalización o acetalización cruzada, un diol reacciona con un acetal o dos acetales diferentes reaccionan entre sí. De nuevo, esto es posible porque todos los pasos de la reacción son equilibrios.
Acetalización catalizada por ácido de 3-nitrobenzaldehído con etanodiol hasta el correspondiente 1,3-dioxolano
Materiales
- Balón de fondo redondo de 500 ml
- Trampa Dean-Stark para líquidos mas livianos que el agua
- Condensador recto
- Agitador magnético con calefacción
- Barra de agitación magnética
- Embudo de separación
- Rotavapor
- matraz Kitasato
- Embudo Büchner
- Desecador
- Baño de aceite
Reactivos
- 3-nitrobenzaldehido (15.1 g)
- Etanodiol (6.83 g – 6,2 ml)
- Ácido 4-toluensulfónico monohidrato (190 mg)
- Ciclohexano (200 ml)
- Tert-butil metil eter (200 ml)
- Bisulfito de sodio (13 g en 20 ml de agua)
- Sulfato de sodio anhidro
- Ciclohexano como disolvente de cristalización
- Tert-butil metil eter como disolvente de cristalización
Procedimiento
Tiempo necesario: 5 horas
Acetalización
- Síntesis – acetalización
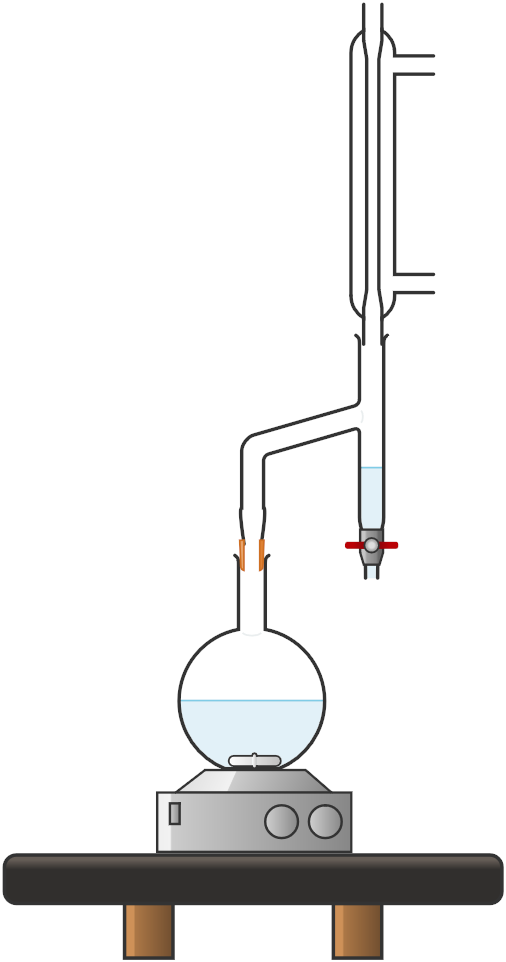
Realizar el siguiente montaje de reflujo con el balón de 500mL, el condensador recto y la trampa Dean-Stark

Disolver 15,1 g (100 mmol) de 3-nitrobenzaldehido, 6,83 g (6,20 mL, 110 mmol) de etanodiol y 1,00 g (5,30 mmol) de ácido 4-toluensulfónico monohidrato en 200 mL de ciclohexano. La mezcla de reacción se refluye hasta que no se recoja más agua en la trampa Dean-Stark (aprox. 2-3 h).
La mezcla de reacción caliente se decanta a otro balón de fondo redondo de 500 mL para separarla del sedimento aceitoso que se deposita en el fondo del matraz (unos 200 mg). El sedimento está formado predominantemente por producto, material de partida y ácido 4-toluensulfónico.
El disolvente de la disolución decantada se elimina en el rotavapor. Se obtiene un sólido cristalino amarillo como producto de reacción. Rendimiento bruto: 19,7 g; pf 50-52 °C.
AnuncioPara eliminar el aldehído sin reaccionar en forma de combinación bisulfítica se disuelve el producto en 200 mL de tert-butil metil eter y se extrae una vez con 20 mL de disolución acuosa saturada de bisulfito de sodio. La fase orgánica se seca sobre sulfato de sodio anhidro, que se elimina por filtración y el disolvente se evapora en el rotavapor para dar un residuo cristalino incoloro.
- Recristalización
El producto es lo suficientemente puro para la mayoría de los usos. Si se desea una mayor pureza, puede recristalizarse de una mezcla ciclohexano/tert-butil metil eter en proporción 1:1(aproximadamente 45 mL). La disolución debe dejarse estar tapada a temperatura ambiente hasta que aparezcan los cristales (puede tardar 1 a 2 días). Si se enfría rápidamente la disolución en un baño de hielo, generalmente se forma únicamente un aceite.
Tras enfriar un breve periodo de tiempo en baño de hielo, se filtran los cristales y se secan hasta peso constante en un desecador a vacío.
Nota
La mezcla de reacción decantada, así como la disolución del extracto en tert-butil metil eter no deben dejarse estar durante mucho tiempo después de la evaporación del disolvente, debido a que las trazas de ácido y agua presentes pueden ocasionar la apertura del acetal. Tampoco debe calentarse la disolución durante más tiempo del necesario durante la recristalización.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Nivel de dificultad: medio
Para más información 1,3-Dioxanes, 1,3-Dioxolanes
Como citar este artículo:
APA: (2022-01-26). Acetalización – síntesis de 1,3 dioxolano. Recuperado de https://quimicafacil.net/manual-de-laboratorio/acetalizacion-sintesis-de-13-dioxolano/
ACS: . Acetalización – síntesis de 1,3 dioxolano. https://quimicafacil.net/manual-de-laboratorio/acetalizacion-sintesis-de-13-dioxolano/. Fecha de consulta 2024-07-27.
IEEE: , "Acetalización – síntesis de 1,3 dioxolano," https://quimicafacil.net/manual-de-laboratorio/acetalizacion-sintesis-de-13-dioxolano/, fecha de consulta 2024-07-27.
Vancouver: . Acetalización – síntesis de 1,3 dioxolano. [Internet]. 2022-01-26 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/acetalizacion-sintesis-de-13-dioxolano/.
MLA: . "Acetalización – síntesis de 1,3 dioxolano." https://quimicafacil.net/manual-de-laboratorio/acetalizacion-sintesis-de-13-dioxolano/. 2022-01-26. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net