Actualizado en enero 9, 2024
Tiempo de lectura estimado: 7 minutos
La cinética química, también conocida como cinética de reacción, es la rama de la química física que se ocupa de comprender las tasas de las reacciones químicas. Debe ser contrastada con la termodinámica, que se ocupa de la dirección en la que ocurre un proceso, pero en sí misma no dice nada sobre su velocidad.
¿Como se modela la cinética química?
La cinética química incluye investigaciones sobre cómo las condiciones experimentales influyen en la velocidad de una reacción química y dan información sobre el mecanismo de la reacción y los estados de transición, así como la construcción de modelos matemáticos que también pueden describir las características de una reacción química.
La reacción objeto de estudio en esta práctica es la oxidación del ion yoduro (I-) por el ion persulfato (S2O82-), cuya estequiometría es:
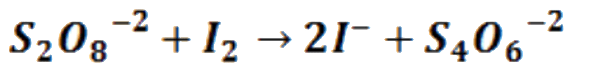
La velocidad de esta reacción podría medirse siguiendo la variación de la concentración de uno de los reactivos o productos con el tiempo. Sin embargo, en este experimento, en vez de realizar un seguimiento continuo de la variación de concentración, se medirá el tiempo requerido para generar una determinada cantidad de yodo.
Esto se lleva a cabo mediante la adición de una cantidad conocida de tiosulfato (S2O3-2) que reacciona con el yodo (I2) a medida que se va formando y lo reduce de nuevo a yoduro a través de la reacción:

Mientras haya tiosulfato presente en la disolución, el yodo reacciona inmediatamente a medida que se va formando y no llega a acumularse. Sin embargo, una vez que todo el tiosulfato se ha consumido el yodo que se forma no reacciona y se acumula en el medio de reacción.
Las disoluciones de yodo son coloreadas (color amarillo las disoluciones diluidas, que va cambiando a pardo rojizo a medida que aumenta la concentración), por lo tanto, puede determinarse la velocidad de reacción midiendo el tiempo que transcurre hasta que el yodo comienza a hacerse visible.
Esta medida puede hacerse de forma más precisa si se añaden unas gotas de disolución indicadora de almidón, ya que este forma un complejo con el yodo que tiene un color azul intenso y que permite apreciar mejor el instante en que empieza a acumularse el yodo.
Velocidad de reacción – Ecuación de velocidad
A temperatura y otras condiciones de reacción constantes, la ecuación de velocidad para la primera reacción es

En este experimento se utiliza el método de velocidades iniciales para determinar los órdenes parciales de reacción n y m. La velocidad de reacción se mide para un intervalo de reacción suficientemente corto, de forma que el porcentaje de reacción transcurrido es pequeño, pero suficiente como para que el tiempo de mezclado no influya sobre la medida.
La estequiometria de la primera reacción nos indica que las velocidades de consumo de persulfato y de formación de yodo son iguales. En cada experimento se mide el tiempo, Δt, que tarda en consumirse una cantidad determinada de tiosulfato (momento en el cual se produce la aparición de la coloración azul).
Como la cantidad de tiosulfato utilizada en estos experimentos es siempre la misma, tanto la cantidad de yodo formada en el tiempo Δt como la cantidad de persulfato que reacciona serán también las mismas. Teniendo en cuenta que la cantidad de tiosulfato añadida es muy inferior a la cantidad inicial de persulfato, y que [S2O8-2] es la misma para todos los experimentos, se puede hacer la siguiente aproximación:
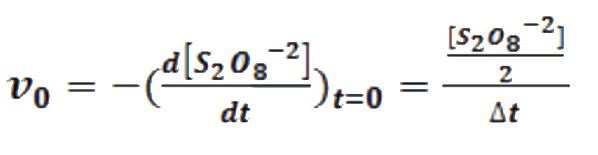
Sustituyendo en la primera ecuación y tomando logaritmos, queda

Por lo tanto, la representación gráfica del logaritmo del lado izquierdo frente al logaritmo de la concentración del ion persulfato a concentración de ion yoduro constante debería dar una línea recta de pendiente m, y una representación del logaritmo del lado izquierdo frente al logaritmo de la concentración del ion yoduro a una concentración del ion sulfato constante debería dar una línea recta de pendiente n.
Influencia de la temperatura en la cinética de reacción.
Ecuación de Arrhenius
La constante de velocidad de muchas reacciones sencillas varía con la temperatura de acuerdo con la ecuación de Arrhenius:

Donde A es el factor pre-exponencial, y Ea la energía de activación de la reacción. Esta ecuación puede linealizarse tomando logaritmos

Puesto que en el intervalo de temperaturas que estamos trabajando la energía de activación es independiente de la temperatura, la representación gráfica de ln k frente a 1/T es una línea recta de pendiente -Ea/R e intercepto en el origen lnA.
Materiales
- 6 Erlenmeyer de 100 mL
- Pipeta automática de volumen variable de 5 mL
- Punta de plástico para pipeta
- Frasco lavador
- Baño termostático
- Cronometro
Reactivos
Soluciones:
- Persulfato de sodio 0.20 M
- Tiosulfato de sodio 0.010 M
- Sulfato de sodio 0.19 M
- Yoduro de potasio 0.25 M
- sulfato de sodio 0.117 M
- yodo 0.60 M
- Sulfato de sodio 0.20 M
- Almidón 1% en peso (indicador)
Procedimiento
Con el fin de obtener la ecuación de velocidad para la reacción se realizan los experimentos indicados en las dos tablas adjuntas mostradas a continuación.

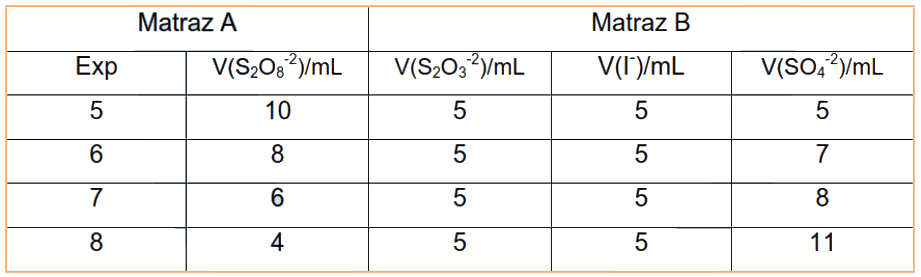
Colocar en un matraz erlenmeyer el volumen indicado de persulfato y 3 gotas de indicador (matraz A), y en otro matraz el volumen indicado de las disoluciones de tiosulfato, yoduro, y sulfato sódico (matraz B). Se colocan en el baño termostático las disoluciones durante 10 minutos, pasado ese tiempo se mezcla el contenido de los dos matraces, agitando bien para homogeneizar la mezcla de reacción. Comenzar a medir el tiempo en que aparece el color azul a partir del momento en que se mezclan las disoluciones.
Después del experimento
Elaborar una tabla que recoja la composición de las disoluciones utilizadas y el tiempo que tardó en aparecer el color azul en cada una de ellas. Determinar m y n, los órdenes de la cinética de reacción con respecto a la concentración de iones persulfato y yoduro, y la constante de velocidad para esas condiciones de reacción.
Realizar el experimento a diferentes temperaturas y con todos los resultados de constante de velocidad y temperatura en una tabla, calcular los parámetros de la ecuación de Arrhenius (energía de activación y factor pre-exponencial).
Para más información THE OXIDATION OF IODIDE ION BY PERSULFATE ION
Como citar este artículo:
APA: (2020-06-24). Cinética de reacción – oxidación del ion yoduro por el ion persulfato. Recuperado de https://quimicafacil.net/manual-de-laboratorio/cinetica-de-reaccion-ion-yoduro-ion-persulfato/
ACS: . Cinética de reacción – oxidación del ion yoduro por el ion persulfato. https://quimicafacil.net/manual-de-laboratorio/cinetica-de-reaccion-ion-yoduro-ion-persulfato/. Fecha de consulta 2024-07-27.
IEEE: , "Cinética de reacción – oxidación del ion yoduro por el ion persulfato," https://quimicafacil.net/manual-de-laboratorio/cinetica-de-reaccion-ion-yoduro-ion-persulfato/, fecha de consulta 2024-07-27.
Vancouver: . Cinética de reacción – oxidación del ion yoduro por el ion persulfato. [Internet]. 2020-06-24 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/cinetica-de-reaccion-ion-yoduro-ion-persulfato/.
MLA: . "Cinética de reacción – oxidación del ion yoduro por el ion persulfato." https://quimicafacil.net/manual-de-laboratorio/cinetica-de-reaccion-ion-yoduro-ion-persulfato/. 2020-06-24. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net