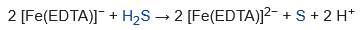Actualizado en enero 9, 2024
Tiempo de lectura estimado: 8 minutos
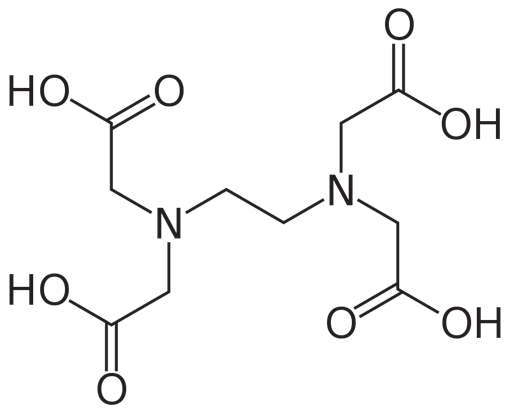
El ácido etilendiaminotetraacético (EDTA) es un ácido aminopolicarboxílico con la fórmula [CH2N(CH2CO2H)2]2. Este sólido blanco, soluble en agua, se utiliza ampliamente para unirse a los iones de hierro y calcio. Se une a estos iones como agente quelante hexadentado («de seis dientes»).
El EDTA se produce en forma de varias sales, en particular el EDTA disódico, el edetato de calcio sódico y el EDTA tetrasódico.
El EDTA fue sintetizado por el químico alemán Ferdinand Münz en 1935, y ese mismo año llenó una patente para su descubrimiento. Se publicó en 1942 sin nombre de inventor porque un juez no lo reconoció como un inventor importante, a pesar de la fama y la alta estima que recibió en esos años. En 1936 presentó una patente para el mismo compuesto en Estados Unidos, en un intento de dar mayor visibilidad a su descubrimiento. Münz no recibió el crédito adecuado por el EDTA y por otros descubrimientos debido a la discriminación que fue común en la Alemania de esa época.
Usos del EDTA
En la industria, el EDTA se utiliza principalmente para secuestrar iones metálicos en solución acuosa. En la industria textil, impide que las impurezas de los iones metálicos modifiquen los colores de los productos teñidos. En la industria de la pasta y el papel, el EDTA inhibe la capacidad de los iones metálicos, especialmente el Mn2+, de catalizar la desproporción del peróxido de hidrógeno, que se utiliza en el blanqueo sin cloro.
Del mismo modo, el EDTA se añade a algunos alimentos como conservante o estabilizador para evitar la decoloración oxidativa catalítica, que es catalizada por los iones metálicos. En las bebidas no alcohólicas que contienen ácido ascórbico y benzoato de sodio, el EDTA mitiga la formación de benceno.
La reducción de la dureza del agua en las aplicaciones de lavandería y la disolución de las incrustaciones en las calderas se basan en el EDTA y en los complejantes relacionados para unir Ca2+, Mg2+ y otros iones metálicos. Una vez unidos al EDTA, es menos probable que estos complejos metálicos formen precipitados o interfieran con la acción de los jabones y detergentes. Por razones similares, las soluciones de limpieza suelen contener EDTA. De forma similar, el EDTA se utiliza en la industria del cemento para la determinación de la cal libre y la magnesia libre en el cemento y los clinkers.
La solubilización de los iones Fe3+ a un pH casi neutro o por debajo de él puede lograrse con EDTA. Esta propiedad es útil en la agricultura, incluida la hidroponía. Sin embargo, dada la dependencia del pH de la formación del ligando, el EDTA no es útil para mejorar la solubilidad del hierro en suelos por encima del neutro.
Por otra parte, a pH casi neutro y superior, el hierro(III) forma sales insolubles, que son menos biodisponibles para las especies vegetales susceptibles. El [Fe(EDTA)]- acuoso se utiliza para eliminar («lavar») el sulfuro de hidrógeno de las corrientes de gas. Esta conversión se consigue oxidando el sulfuro de hidrógeno a azufre elemental, que no es volátil:
En esta aplicación, el centro de hierro(III) se reduce a su derivado de hierro(II), que puede ser reoxidado por el aire. De manera similar, los óxidos de nitrógeno se eliminan de las corrientes de gas utilizando [Fe(EDTA)]2-. Las propiedades oxidantes del [Fe(EDTA)]– también se aprovechan en fotografía, donde se utiliza para solubilizar partículas de plata.
El EDTA se utilizó en la separación de los metales lantánidos por cromatografía de intercambio iónico. Perfeccionado por F. H. Spedding y otros en 1954, el método se basa en el aumento constante de la constante de estabilidad de los complejos de lantánidos del EDTA con el número atómico.
Utilizando perlas de poliestireno sulfonado y Cu2+ como ion retenedor, el EDTA hace que los lantánidos migren por la columna de resina mientras se separan en bandas de lantánidos puros. Los lantánidos eluyen en orden de número atómico decreciente. Debido al coste de este método, en relación con la extracción con disolventes en contracorriente, el intercambio iónico se utiliza ahora sólo para obtener las mayores purezas de lantánidos (normalmente superiores al 99,99%).
Aplicaciones en el laboratorio
En el laboratorio, el EDTA se utiliza ampliamente para eliminar los iones metálicos: En bioquímica y biología molecular, la eliminación de iones se utiliza habitualmente para desactivar enzimas dependientes de metales, ya sea como ensayo de su reactividad o para suprimir el daño al ADN, las proteínas y los polisacáridos.
El EDTA también actúa como inhibidor selectivo contra las enzimas hidrolizadoras de dNTP (Taq polimerasa, dUTPasa, MutT), arginasa hepática y peroxidasa de rábano picante independientemente de la quelación de iones metálicos. Estos hallazgos obligan a replantear la utilización del EDTA como eliminador de iones metálicos bioquímicamente inactivo en los experimentos enzimáticos.
En química analítica, el EDTA se utiliza en valoraciones complexométricas y en el análisis de la dureza del agua o como agente de enmascaramiento para secuestrar los iones metálicos que podrían interferir en los análisis.
El EDTA tiene muchos usos especializados en los laboratorios biomédicos, como en la oftalmología veterinaria como anticolagenasa para evitar el empeoramiento de las úlceras corneales en los animales. En el cultivo de tejidos, el EDTA se utiliza como agente quelante que se une al calcio e impide la unión de las caderinas entre las células, lo que evita la aglomeración de las células cultivadas en suspensión líquida o el desprendimiento de las células adheridas para su paso.
En histopatología, el EDTA puede utilizarse como agente descalcificador que permite cortar secciones con un microtomo una vez que la muestra de tejido está desmineralizada. También se sabe que el EDTA inhibe una serie de metalopéptidas; el método de inhibición se produce a través de la quelación del ion metálico necesario para la actividad catalítica. El EDTA también puede utilizarse para comprobar la biodisponibilidad de los metales pesados en los sedimentos. Sin embargo, puede influir en la biodisponibilidad de los metales en solución, lo que puede plantear problemas en cuanto a sus efectos en el medio ambiente, especialmente teniendo en cuenta sus usos y aplicaciones generalizados.
El EDTA también se utiliza para eliminar la suciedad (metales corroídos) de las barras de combustible en los reactores nucleares.
EDTA y la química de coordinación
En la química de coordinación, el EDTA4- es un miembro de la familia de ligandos del ácido aminopolicarboxílico. El EDTA4- suele unirse a un catión metálico a través de sus dos aminas y cuatro carboxilatos. Muchos de los compuestos de coordinación resultantes adoptan una geometría octaédrica. Aunque de poca importancia para sus aplicaciones, estos complejos octaédricos son quirales.
El anión de cobalto(III) [Co(EDTA)]– se ha resuelto en enantiómeros. Muchos complejos de EDTA4- adoptan estructuras más complejas debido a la formación de un enlace adicional al agua, es decir, complejos de siete coordenadas, o al desplazamiento de un brazo de carboxilato por el agua.
El complejo de hierro(III) del EDTA es de siete coordenadas. Los primeros trabajos sobre el desarrollo del EDTA fueron realizados por Gerold Schwarzenbach en la década de 1940. El EDTA forma complejos especialmente fuertes con Mn(II), Cu(II), Fe(III), Pb(II) y Co(III).
Varias características de los complejos de EDTA son relevantes para sus aplicaciones. En primer lugar, debido a su alta denticidad, este ligando tiene una gran afinidad por los cationes metálicos:
Escrito de esta manera, el cociente de equilibrio muestra que los iones metálicos compiten con los protones para unirse al EDTA. Debido a que los iones metálicos son ampliamente envueltos por el EDTA, sus propiedades catalíticas son a menudo suprimidas. Por último, como los complejos de EDTA4- son aniónicos, tienden a ser muy solubles en agua. Por esta razón, el EDTA es capaz de disolver los depósitos de óxidos y carbonatos metálicos.
Los valores de pKa del EDTA libre son 0, 1,5 (desprotonación de los dos grupos amino), 2, 2,66, 6,16 y 10,24 (desprotonación de los cuatro grupos carboxilo).
Para más información Ferdinand Münz: EDTA and 40 years of inventions
Como citar este artículo:
APA: (2022-01-25). EDTA. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/edta/
ACS: . EDTA. https://quimicafacil.net/compuesto-de-la-semana/edta/. Fecha de consulta 2024-07-27.
IEEE: , "EDTA," https://quimicafacil.net/compuesto-de-la-semana/edta/, fecha de consulta 2024-07-27.
Vancouver: . EDTA. [Internet]. 2022-01-25 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/edta/.
MLA: . "EDTA." https://quimicafacil.net/compuesto-de-la-semana/edta/. 2022-01-25. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net