Actualizado en enero 9, 2024
Tiempo de lectura estimado: 5 minutos
La carvona es un miembro de la familia de los terpenoides. Se encuentra naturalmente en muchos aceites esenciales, pero es más abundante en los aceites de las semillas de alcaravea (Carum carvi), menta (Mentha spicata) y eneldo.
Historia de la carvona
La alcaravea fue utilizada con fines medicinales por los antiguos romanos, pero probablemente la carvona no fue aislada como un compuesto puro hasta que Franz Varrentrapp (1815-1877) la obtuvo en 1849. Originalmente fue llamada carvol por Schweizer. Goldschmidt y Zürrer lo identificaron como una cetona relacionada con el limoneno, y la estructura fue finalmente dilucidada por Georg Wagner (1849-1903) en 1894.

Estereoisomerismo y olor de la carvona
La carvona forma dos formas especulares o enantiómeros: R-(-)-carvona, o L-carvona, que tiene un olor a menta dulce, como las hojas de menta. Su imagen especular, S-(+)-carvona, o D-carvona, tiene un aroma picante con notas de centeno, como las semillas de alcaravea.
El hecho de que los dos enantiómeros se perciban con un olor diferente es una prueba de que los receptores olfativos deben contener grupos quirales, lo que les permite responder con mayor fuerza a un enantiómero que al otro. No todos los enantiómeros tienen olores distinguibles. También se ha encontrado que los monos ardilla son capaces de discriminar entre los enantiómeros de esta molécula.
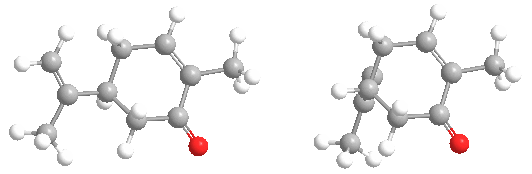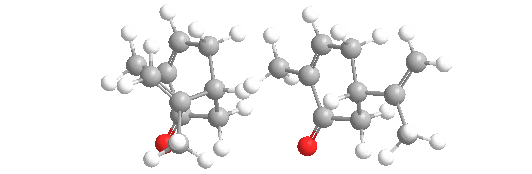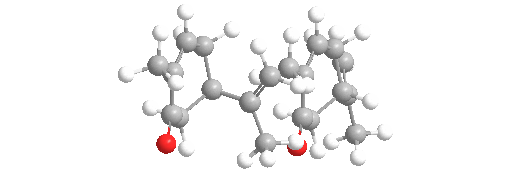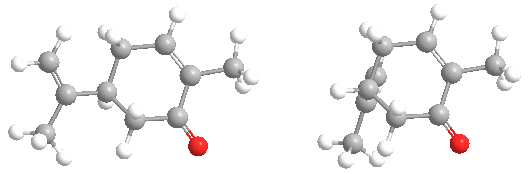
Las dos formas también se denominan con los nombres más antiguos de laevo (L) que se refiere a R-(-)-carvona, y dextro (D) que se refiere a S-(+)-carvona.
Síntesis y obtención
La forma dextro, S-(+)-carvona se obtiene prácticamente pura por la destilación fraccionada del aceite de alcaravea. La forma levo obtenida de los aceites que la contienen suele requerir un tratamiento adicional para producir R-(-)-carvona de alta pureza. Esto puede lograrse mediante la formación de un compuesto de adición con sulfuro de hidrógeno, a partir del cual la carvona puede regenerarse mediante el tratamiento con hidróxido de potasio en etanol y luego destilando el producto en una corriente de vapor.
Este compuesto puede prepararse sintéticamente a partir del limoneno mediante el nitrosocloruro de limoneno, que puede formarse mediante el tratamiento del limoneno con nitrito de isoamilo en ácido acético glacial. Este compuesto se convierte entonces en carvoxima, lo que puede lograrse mediante el reflujo con DMF en isopropanol. El reflujo de carvoxima con ácido oxálico al 5% produce carvona.
Este procedimiento permite obtener R-(-)-carvona a partir de R-(+)-limoneno. El uso principal del d-limoneno es como precursor de la S-(+)-carvona. La disponibilidad a gran escala de cáscaras de naranja, un subproducto en la producción de jugo de naranja ha hecho que el limoneno esté disponible a bajo costo y que la carvona sintética se prepare de esta manera a bajo costo.
Su biosíntesis ocurre por oxidación del limoneno.
Principales usos
Ambas formas de este compuesto se utilizan en la industria alimentaria y de sabores. R-(-)-Carvona también se utiliza para productos ambientadores y, como muchos aceites esenciales, los aceites que contienen carvona se utilizan en aromaterapia y medicina alternativa. La S-(+)-Carvona ha demostrado un efecto supresor contra el aumento de peso inducido por una dieta alta en grasas en ratones.
Como el compuesto responsable del sabor de la alcaravea, el eneldo y la menta, esta molécula se ha utilizado durante milenios en la alimentación. La goma de mascar de menta y los Life Savers® con sabor a menta de Wrigley son los principales usuarios del aceite natural de menta de Mentha spicata. La semilla de alcaravea se extrae con alcohol para hacer la bebida europea Kümmel®.
La S-(+)-Carvona también se utiliza para evitar la brotación prematura de las patatas durante el almacenamiento, siendo comercializada en los Países Bajos para este fin bajo el nombre de Talent. Se ha propuesto el uso de (R)-(-)-Carvona como repelente de mosquitos y la Agencia de Protección Ambiental de los Estados Unidos está revisando una solicitud para registrarlo como pesticida.
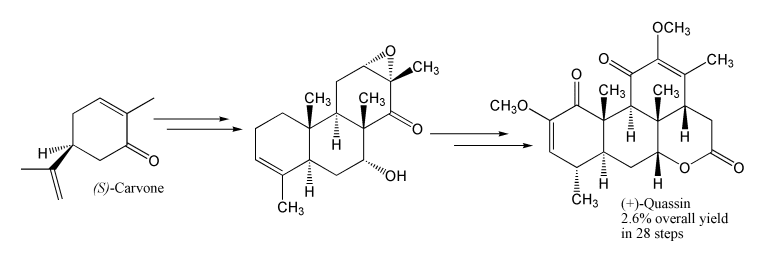
La molécula está disponible de forma económica en ambas formas enantioméricamente puras, lo que la convierte en un atractivo material de partida para la síntesis total asimétrica de productos naturales. Por ejemplo, la (S)-(+)-carvona se usó para empezar una síntesis de 1998 del terpenoide cuasina
Para más información carvone – University of Hertfordshire
Como citar este artículo:
APA: (2020-03-17). Carvona. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/carvona/
ACS: . Carvona. https://quimicafacil.net/compuesto-de-la-semana/carvona/. Fecha de consulta 2024-07-27.
IEEE: , "Carvona," https://quimicafacil.net/compuesto-de-la-semana/carvona/, fecha de consulta 2024-07-27.
Vancouver: . Carvona. [Internet]. 2020-03-17 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/carvona/.
MLA: . "Carvona." https://quimicafacil.net/compuesto-de-la-semana/carvona/. 2020-03-17. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net