Actualizado en mayo 22, 2023
Tiempo de lectura estimado: 6 minutos
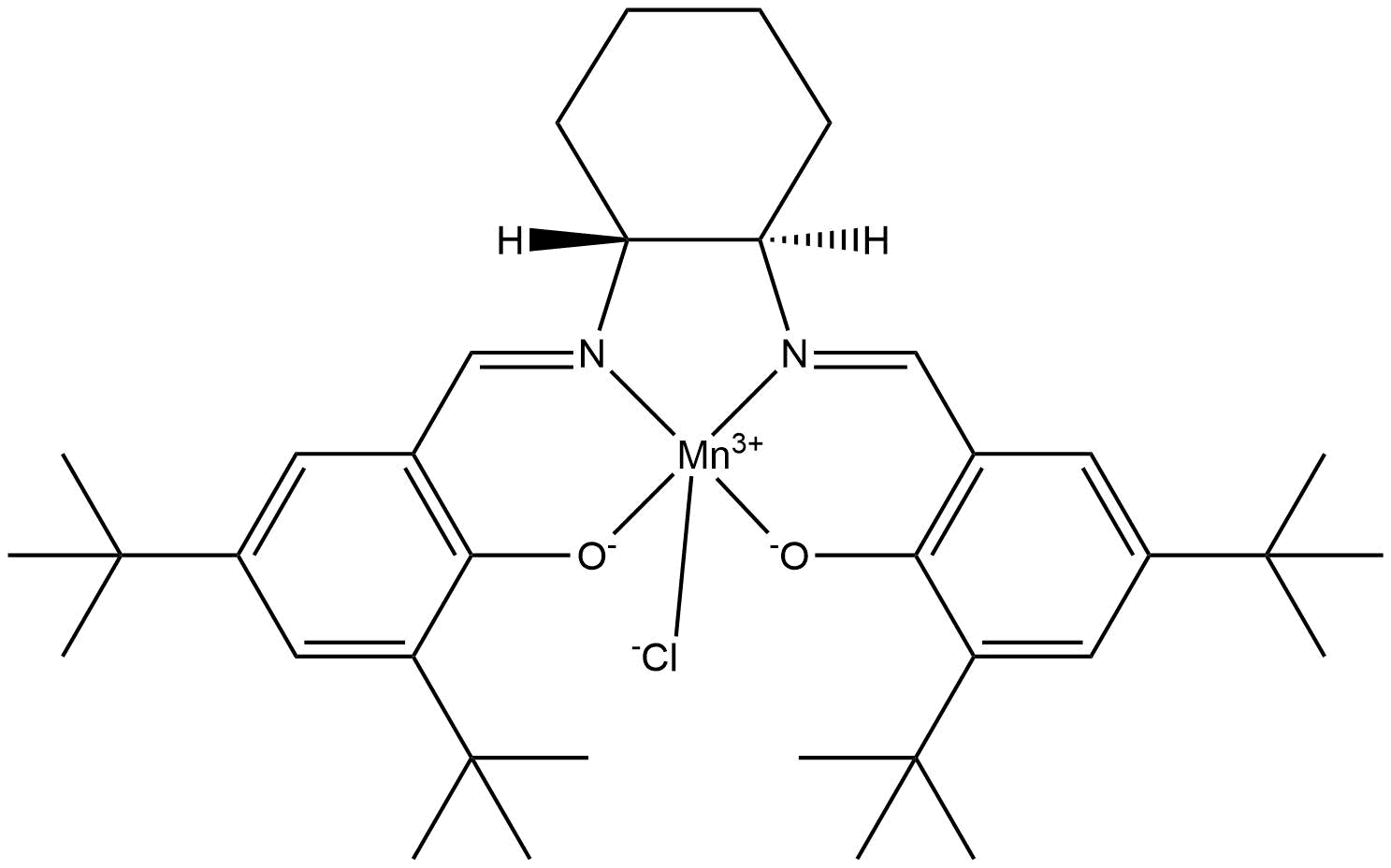
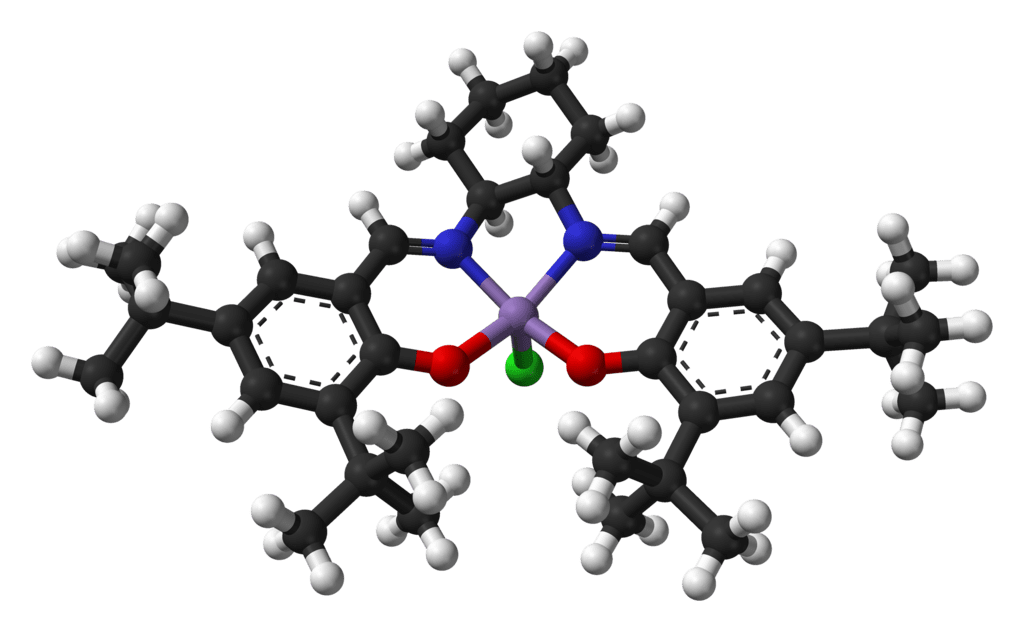
El catalizador de Jacobsen es el nombre común del cloruro de N,N’-bis(3,5-di-terc-butilsalicilideno)-1,2-ciclohexanodiaminomanganeso(III), un compuesto de coordinación de manganeso y un ligando de tipo sal.
Se utiliza como un catalizador asimétrico en la epoxidación de Jacobsen, la cual es reconocida por su habilidad para transformar enantioselectivamente los alquenos proquirales en epóxidos. Antes de su desarrollo, los catalizadores para la epoxidación asimétrica de alquenos requerían que el sustrato tuviera un grupo funcional dirigente, tal como un alcohol como se ve en la epoxidación de Sharpless. Este compuesto tiene dos enantiómeros, los cuales dan el producto epóxico apropiado del material de partida del alqueno.
Los epóxidos enantioméricamente puros son deseables como bloques de construcción para moléculas complejas con quiralidad específica. Los compuestos biológicamente activos pueden exhibir una actividad radicalmente diferente basada en las diferencias de quiralidad y por lo tanto la capacidad de obtener estereocentros deseados en una molécula es de gran importancia para la industria farmacéutica
El catalizador de Jacobsen y otros catalizadores asimétricos son particularmente útiles en este campo; por ejemplo, el catalizador de Jacobsen fue usado para sintetizar fenilisoserina, una cadena lateral de la famosa droga anticancerígena Taxol, en una síntesis de cuatro pasos en 1992.
Estructura y propiedades
El catalizador de Jacobsen es típico de un catalizador de oxidación de metales de transición: tiene un centro metálico de alta valencia en un ambiente donante de nitrógeno y oxígeno. El ligando de quelante del catalizador de Jacobsen es tetradentado, lo que significa que se une al metal central de manganeso a través de cuatro enlaces, uno para cada átomo de oxígeno y nitrógeno de la espina dorsal estructural del catalizador. Pertenece a una clase de ligandos de diimina quiral que se sintetizan a través de la condensación de la base de Schiff.

Síntesis del catalizador de Jacobsen
Ambos enantiómeros del catalizador de Jacobsen están disponibles comercialmente. El catalizador de Jacobsen puede prepararse separando 1,2-diaminociclohexano en sus enantiómeros componentes y luego reaccionando el tartrato apropiado con 3,5-di-terc-butil-2-hidroxibenzaldehído para formar una base de Schiff (ver el intermedio formado en el esquema de reacción).
La reacción con acetato de manganeso (II) en presencia de aire da el complejo de manganeso (III), que puede ser aislado como el cloro derivado después de la adición de cloruro de litio. A continuación se muestra la preparación del enantiómero (R,R).
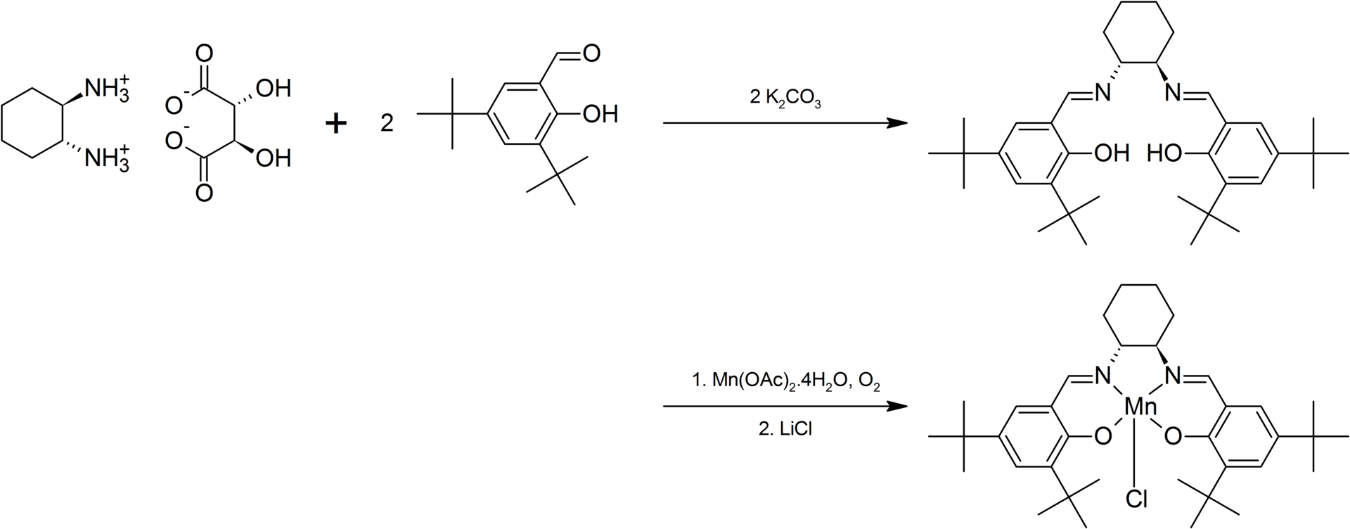
Mecanismo de reacción del catalizador de Jacobsen
En general, se han sugerido dos mecanismos de reacción. Debido a que el catalizador de Jacobsen epoxida los alquenos conjugados (es decir, aquellos en los que hay múltiples dobles enlaces en carbones alternados) de manera más efectiva, el mecanismo generalmente aceptado se basa en un intermedio radical que se estabiliza debido a la naturaleza conjugada del sustrato.
En el caso de los alquenos no conjugados, el sustrato es mucho menos capaz de estabilizar un radical, lo que hace más improbable un radical intermedio. En este caso, es probable un mecanismo concertado en el que la unión al oxígeno se rompe simultáneamente con el metal central mientras se forma con el sustrato. Sin embargo, estudios más recientes han indicado que un intermedio radical es posible, desafiando la suposición de que los alquenos no conjugados se someten a los mecanismos propuestos.
En la reacción catalítica original, se utilizaron iodosilarenos (PhIO) como oxidante estequiométrico, pero poco después se descubrió que el hipoclorito de sodio (NaClO), una alternativa más barata, también funciona. Aunque posteriormente se han utilizado otros oxidantes, el hipoclorito sigue siendo el más común.
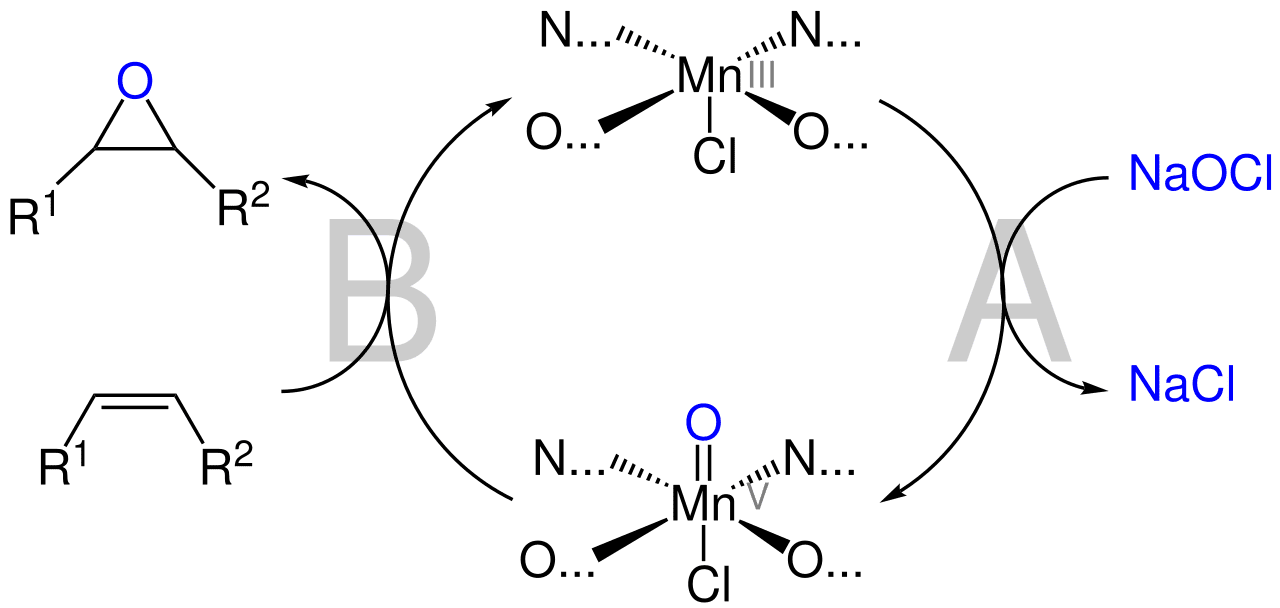
Después de la adición del oxidante al sistema, O=Mn(V), es generalmente aceptado como la especie de oxidante activo formado (paso A). Se piensa que el sustrato se aproxima al enlace metal-oxo desde el lado en una orientación perpendicular en relación con el catalizador para permitir un solapamiento orbital favorable.
Origen del mecanismo
Este mecanismo, que fue propuesto originalmente por John Groves para explicar las reacciones de epoxidación catalizada por las porfirinas, se conoce comúnmente como «aproximación perpendicular de lado». El enfoque se realiza sobre el puente de diamina, donde la masa estérica de los grupos terc-butil en la periferia del ligando no interfiere con el enfoque del alqueno. Sin embargo, como es el caso del mecanismo general, la vía del enfoque del alqueno también se debate.
La facilidad con la que el catalizador de Jacobsen epoxidiza selectivamente cis-alquenos ha sido difícil de replicar con terminales y trans-alquenos. Sin embargo, los cambios estructurales en el ligando y las adaptaciones al protocolo para la reacción de epoxidación han llevado a algunos éxitos en estas áreas.
Por ejemplo, los derivados del catalizador de Jacobsen con cambios estructurales menores en la espina dorsal del catalizador se han utilizado en conjunto con bajas temperaturas y el oxidante ácido m-cloroperbenzoico (m-CPBA) para epoxidar el estireno alqueno terminal.
La baja temperatura de la reacción favorece sólo una vía, la vía cis, mientras que el m-CPBA se utiliza debido al alto punto de congelación del agua. Poco éxito ha tenido la epoxidación de los alquenos trans por compuestos de manganeso, pero otros compuestos de coordinación de venta, como los complejos de oxocromo, pueden ser usados.
La estructura de ligandos del catalizador de Jacobsen se modifica fácilmente para su uso en una amplia gama de reacciones, tales como aberturas de anillos de epóxidos, reacciones de Diels-Alder y adiciones de conjugados. Por ejemplo, se ha utilizado un catalizador análogo con un centro metálico de aluminio para la carbonilación de epóxidos con el fin de obtener betalactonas.
Para más información (R,R)-Jacobsen’s catalyst | C36H52ClMnN2O2 – PubChem
Hanson, John. (2001). «Synthesis and Use of Jacobsen’s Catalyst: Enantioselective Epoxidation in the Introductory Organic Laboratory«. J. Chem. Educ. 78: 1266.
Como citar este artículo:
APA: (2020-06-02). Catalizador de Jacobsen. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/catalizador-de-jacobsen/
ACS: . Catalizador de Jacobsen. https://quimicafacil.net/compuesto-de-la-semana/catalizador-de-jacobsen/. Fecha de consulta 2024-07-27.
IEEE: , "Catalizador de Jacobsen," https://quimicafacil.net/compuesto-de-la-semana/catalizador-de-jacobsen/, fecha de consulta 2024-07-27.
Vancouver: . Catalizador de Jacobsen. [Internet]. 2020-06-02 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/catalizador-de-jacobsen/.
MLA: . "Catalizador de Jacobsen." https://quimicafacil.net/compuesto-de-la-semana/catalizador-de-jacobsen/. 2020-06-02. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net