Tiempo de lectura estimado: 6 minutos
El test de coloración a la llama (también llamada prueba de llama o ensayo a la llama) es una técnica básica de identificación de elementos en química inorgánica.
Cada elemento cuando es excitado genera la emisión de una luz característica que puede ser estudiada y es el fundamento de las técnicas espectroscópicas que actualmente se emplean en laboratorios de todo el mundo.
El ensayo a la llama es utilizado para identificar los iones metálicos en compuestos y es más útil para ciertos elementos que para otros, en particular para los elementos del grupo 1. A continuación se mostraran dos métodos para realizar esta experiencia.
Teoría del ensayo a la llama
La radiación electromagnética esta compuesta de ondas que oscilan y son caracterizadas por su longitud de onda (λ) y frecuencia (ν). La longitud de onda se define como la distancia entre dos crestas (o valles) en una onda y a su vez, la frecuencia es definida como el número de ondas que pasa a través de un determinado punto, se mide en # ondas/ segundo (Hertz).

Sabiendo que todas las ondas electromagnéticas viajan a la velocidad de la luz ((c), = 2.998×108m/s.) se puede emplear la siguiente ecuación para relacionar la longitud de onda y la frecuencia con la velocidad de la onda electromagnética.
c=λ×ν
También se puede cuantificar la energía emitida a través de paquetes discretos de energía llamado fotones. Para cuantificar la energía por fotón en Joules se emplea la siguiente ecuación.
Energía foton=h×ν
Siendo h la constante de Planck, que tiene un valor de 6.626×10−34J⋅s
La radiación electromagnética tiene diversas longitudes de onda que van desde 400 nm o menos (ultravioleta) hasta 700 nm o más (infrarrojo). La luz visible es el ejemplo mas familiar de la radiación electromagnética y el color que percibimos es un reflejo de la energía que emite o rechaza un cuerpo.
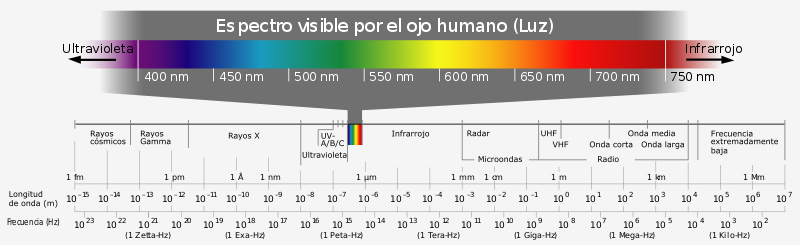
En el test a la llama (o coloración a la llama), un átomo o ion absorbe energía y los electrones saltan de niveles de energía bajos a altos. Cuando el electrón regresa a su estado de energía bajo, libera esta energía predominantemente en forma de radiación electromagnética, la cual es percibida como una luz con un color determinado.
Si la luz emitida por los electrones es separada, se puede detectar líneas de diferentes colores, esto es llamado espectro de emisión y sirve como huella digital de un elemento determinado.

A simple vista, cuando un elemento es excitado a través de la llama, el espectro de emisión parecerá un solo color, este color resulta de la combinación de todos los colores de su espectro de emisión dependiendo de sus intensidades. Aun así, el test de color a la llama (o coloración a la llama) es una herramienta útil si se requiere identificar de manera rápida y sencilla la presencia de un elemento.
Materiales
- Asas de platino o nicromo (pueden ser asas bacteriológicas de estos materiales) con punta en forma de aro
- Mechero Bunsen
Reactivos
- Ácido clorhídrico concentrado
- Agua destilada
Soluciones acuosas 1M de los siguientes compuestos de cloro
- Cloruro de litio
- Cloruro de sodio
- Cloruro de potasio
- Cloruro de cobre
- Cloruro de bario
- Cloruro de calcio
Nota: estos compuestos son sugeridos, se pueden emplear sales inorgánicas u orgánicas para ver su comportamiento en el ensayo a la llama.
Procedimiento
Tiempo necesario: 30 minutos
Procedimiento – Ensayo a la llama
Se deben limpiar las asas sumergiéndolas en una solución concentrada de acido clorhídrico (HCl) y calentando las asas en el borde no luminoso de la llama de un mechero Bunsen ajustado para máximo rendimiento. Se debe repetir el procedimiento hasta que no se perciba la generación de ningún color desde el asa
Precaución: Tener cuidado al momento de manipular el ácido clorhídrico concentrado y evitar su contacto con la piel.Tomar una pequeña cantidad de las soluciones disponibles en el aro del asa y acercarlo a la llama del mechero Bunsen, se generará una llama en el asa de un color característico. Observar y anotar dicho color.
AnuncioSe puede repetir el procedimiento con la misma solución varias veces, sin embargo, no se debe usar un mismo asa en distintas soluciones sin limpiarla primero según el procedimiento anteriormente descrito. Dejar el cloruro de sodio como la última solución a trabajar pues el sodio es de difícil limpieza.
Otro procedimiento para hacer el test de coloración a la llama es tomar una pequeña cantidad de cada solución y esparcirla con la ayuda de un rociador o spray plástico sobre la llama del mechero Bunsen. Se observará un color en toda la llama.
Después del experimento
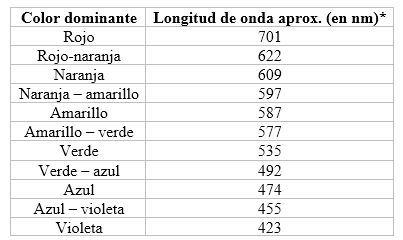
Después de identificar la longitud de onda aproximada para cada elemento en el ensayo a la llama, es posible calcular la frecuencia de emisión, así como la energía emitida con las ecuaciones anteriormente dadas. También se puede ordenar de mayor a menor la energía, longitudes de onda y frecuencia de los elementos presentes en las soluciones de trabajo.
Recomendaciones de seguridad
Manejar con precaución el mechero Bunsen, mantener alejado cualquier liquido o gas inflamable durante la experiencia. Usar gafas de seguridad, bata de laboratorio y guantes adecuados. Mantener una distancia prudencial al mechero mientras se realiza la experiencia. Disponer de los residuos de manera adecuada y acorde a las normas del laboratorio, locales y nacionales que apliquen.
Mayor información
Metal Ion Flame Test Colours Chart
Como citar este artículo:
APA: (2018-08-08). Ensayo a la llama. Recuperado de https://quimicafacil.net/manual-de-laboratorio/coloracion-a-la-llama/
ACS: . Ensayo a la llama. https://quimicafacil.net/manual-de-laboratorio/coloracion-a-la-llama/. Fecha de consulta 2026-02-23.
IEEE: , "Ensayo a la llama," https://quimicafacil.net/manual-de-laboratorio/coloracion-a-la-llama/, fecha de consulta 2026-02-23.
Vancouver: . Ensayo a la llama. [Internet]. 2018-08-08 [citado 2026-02-23]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/coloracion-a-la-llama/.
MLA: . "Ensayo a la llama." https://quimicafacil.net/manual-de-laboratorio/coloracion-a-la-llama/. 2018-08-08. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net