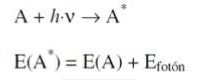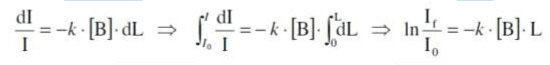Actualizado en enero 9, 2024
Tiempo de lectura estimado: 10 minutos
Si una muestra contiene 2 analitos con espectros de absorción traslapados, se puede determinar alguno de ellos midiendo la absorbancia en su máxima longitud de onda sin que haya interferencia del otro soluto de acuerdo con la ley de Lambert-Beer, este método es conocido como el método de adición de absorbancias.
Se debe determinar la absortividad molar de ambos analitos en sus longitudes de máxima absorción y determinar la absorción de la mezcla a la máxima longitud de onda de cada analito. Habrá traslape entre los espectros de absorción, sin embargo, el único requisito es que las longitudes de máxima absorción no coincidan.
Método de adición de absorbancias
Las moléculas pueden absorber energía luminosa y almacenarla en forma de energía interna. La Mecánica Cuántica indica que la luz está compuesta de fotones cada uno de los cuáles tiene una energía según la siguiente ecuación:
donde c es la velocidad de la luz, ν es su frecuencia, λ su longitud de onda y h= 6.6 * 10-34 J×s es la constante de Planck. Cuando decimos que una sustancia química absorbe luz de longitud de onda l, esto significa que las moléculas de esa sustancia absorben fotones de esa longitud de onda.
En la técnica de espectroscopia UV-vis, se emplea la absorción de luz en el ultravioleta cercano (λ = 325-420 nm) y en el visible (λ = 420-900 nm). Cuando una molécula absorbe un fotón en este intervalo espectral, se excita pasando un electrón de un orbital del estado fundamental a un orbital excitado de energía superior. De esta manera la molécula almacena la energía del fotón:
Como la energía se conserva, la diferencia de energía entre el estado fundamental de la molécula (A) y su estado excitado (A*) debe ser exactamente igual a la energía del fotón. Es decir, una molécula sólo puede absorber fotones cuya energía h×n sea igual a la energía de un estado molecular excitado.
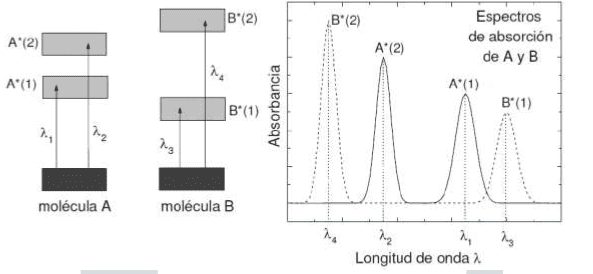
Cada molécula tiene una serie de estados excitados discretos (o bandas) que dependen de su estructura electrónica y que la distinguen del resto de moléculas. Como consecuencia, el espectro de absorción, es decir, la luz absorbida en función de la longitud de onda constituye una verdadera representación de identidad de cada sustancia o molécula.
También es posible analizar una mezcla de dos compuestos midiendo su espectro de ultravioleta/visible y cuantificar la concentración de uno o de ambos empleando el método de adición de absorbancias. Cuando dos o más sustancias aparecen mezcladas en una misma muestra sus espectros de absorción aparecen superpuestos:
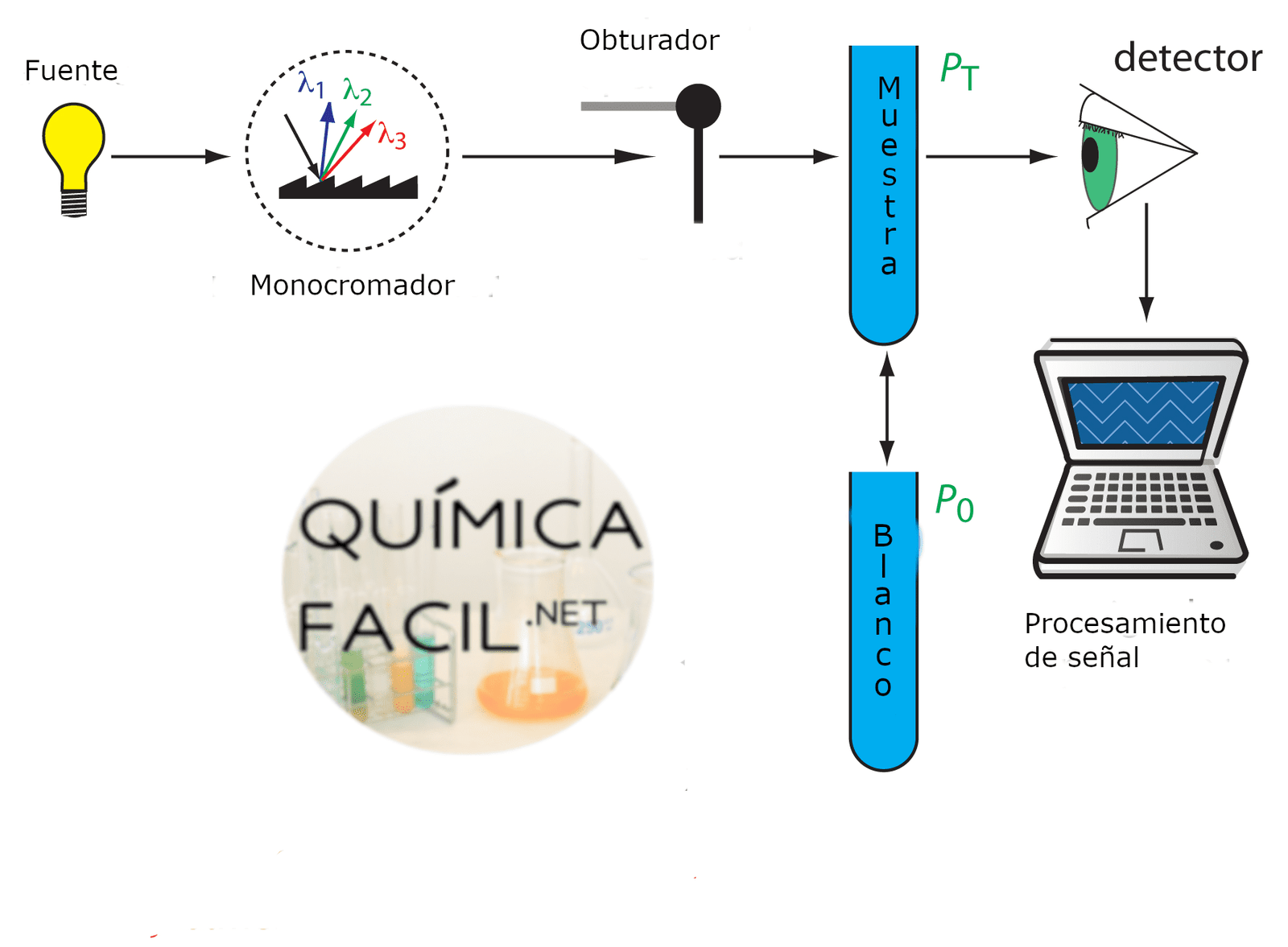
Los espectros de absorción se miden mediante un instrumento denominado espectrómetro. Estos instrumentos constan de una fuente de luz “blanca” caracterizada por un espectro de emisión continuo en un intervalo amplio de longitudes de onda (por ejemplo 325 nm – 900 nm) y de un monocromador que actúa como filtro óptico transmitiendo un haz de luz de longitud de onda fija λ e intensidad I0. Este haz de luz traspasa la cubeta de análisis donde se encuentra la muestra a analizar. Un detector sensible a la luz mide la intensidad del haz a la salida.
La intensidad del haz de luz se va atenuando a medida que atraviesa la muestra debido a la absorción de las moléculas de la muestra. El ritmo de absorción depende de la intensidad inicial de luz y de la concentración de moléculas. De esta manera, cuando un haz de luz de intensidad I recorre una distancia dL en una muestra con una concentración de moléculas [B], se produce una atenuación de intensidad dI dada por:
La constante k se denomina coeficiente de absortividad molar. La expresión anterior se puede integrar de la siguiente forma:
lo cual da lugar a la ley de Beer-Lambert para la absorción que relaciona la intensidad a la salida y la muestra If, con la intensidad inicial I0, la concentración de moléculas y la distancia recorrida por la luz en la muestra, L.
El espectrofotómetro, en lugar de la intensidad, mide la absorbancia A que se define por:
La utilización de la absorbancia al realizar los espectros tiene la ventaja de ser directamente proporcional a la concentración de moléculas en la muestra.
La ley de aditividad de absorbancias establece que la absorbancia total de varias sustancias en mezcla es la suma de las absorbancias individuales, siempre y cuando no haya interacciones químicas entre las moléculas y si los coeficientes de extinción molar en la mezcla coinciden con los coeficientes determinados en solución individual.
Por lo tanto, en un sistema de dos sustancias, que las podemos llamar X y Y, a una longitud de onda 1, podemos enunciar la ley de Lambert – Beer para cada sustancia
Se puede hacer lo mismo para una longitud de onda 2
Para cada longitud de onda, podemos sumar las dos expresiones, que quedan de la siguiente forma
Si se reemplazan los valores de absorción, coeficiente de extinción molar para cada longitud de onda y cada sustancia y el valor del paso de celda (generalmente es 1 cm), se obtiene un sistema de dos ecuaciones con dos incógnitas (las concentraciones de cada sustancia). Este sistema se puede resolver por el método algebraico de preferencia.
Es posible hacer el mismo ejercicio para tres sustancias, en dicho caso, es necesario conocer la absorbancia en tres longitudes de onda distinta y el sistema de ecuaciones será de tres ecuaciones con tres incógnitas.
Materiales
- Balón aforado de 100 mL
- Balón aforado de 25 mL
- Vaso de precipitados de 25 mL
- Vaso de precipitados de 50 mL
- Pipetas aforadas de 1, 5 y 10 mL
- Propipeta o pipeteador
- Vidrio de reloj
- Cubeta para espectroscopia UV-vis
- Equipo de UV-vis
- Balanza analítica
- Plancha de calentamiento
Reactivos
- Cafeína grado analítico
- Ácido acetilsalicílico grado analítico
- Solución de hidróxido de sodio 4M
- Agua tridestilada
- Muestra de analgésico comercial con cafeína y ácido acetilsalicílico en su composición
Procedimiento – Método de adición de absorbancias
Preparar una solución estándar de cafeína pesando 38.8 mg y agregando 50 mL de metanol. Agregar 10 gotas de solución de hidróxido de sodio 4M y calentar suavemente a baño de María con un vidrio de reloj como tapa, por espacio de 15 minutos. Dejar enfriar, trasvasar a un balón aforado de 200 mL y llevar a volumen.
Realizar la misma operación para preparar la solución estándar de ácido acetilsalicílico usando 180 mg de reactivo.
Obtener el espectro de cada solución por separado realizando un barrido entre 200-350 nm. Recuerde utilizar cubetas diferentes para cada solución o en su defecto enjuagar la celda con agua destilada entre cada medición.
Empleando los espectros obtenidos del barrido realizado con cada sustancia, determinar las dos longitudes de onda de absorción máxima para la cafeína y para el ácido acetilsalicílico. Comparar si las longitudes de onda a las que se obtienen los valores máximos de cada sustancia son las mismas en ambas sustancias, si no lo son, escoger dos longitudes de onda donde la absorción de ambas sustancias sea significativa, ya que estas longitudes serán las escogidas para la medición de la absorción en la mezcla problema.
A partir de las soluciones patrón de cafeína y acido acetilsalicílico, realizar una curva de calibración para cada una de las sustancias con las concentraciones mencionadas en la tabla, leyendo la absorción a las dos longitudes de onda determinadas anteriormente. Empleando la forma integrada de la ley de Lambert – Beer, determinar el coeficiente de extinción molar para cada sustancia a las diferentes concentraciones. Finalmente, calcular un coeficiente de extinción molar promedio a cada longitud de onda para cada sustancia.
Preparar un blanco con 12.5 mL de metanol, 3 gotas de hidróxido de sodio 4M y aforar a 50 mL con agua tridestilada. Este blanco permitirá determinar la absorción de los solventes y del hidróxido de sodio y restar su influencia en la medición.
Preparar una solución de analgésico comercial moliendo una tableta y disolviendo el polvo en 50 mL de metanol. Calentar el vaso a baño de María cubriendo la boca del vaso con un vidrio de reloj por espacio de 15 minutos, dejar enfriar y transferir a un balón aforado de 200 mL. Aforar con metanol.
Tomar 1 mL de la anterior solución y aforar a 100 mL. Leer las absorbancias a las longitudes de onda identificadas.
Después del experimento
Escribir el sistema de ecuaciones que permite determinar la concentración tanto de cafeína como de ácido acetilsalicílico en el analgésico comercial según la ley de aditividad de absorbancias (método de adición de absorbancias). Resolver el sistema y comparar con lo reportado en literatura sobre concentración de ambas sustancias en productos comerciales.
Consultar las limitaciones del empleo de la ley de aditividad de absorbancias o método de adición de absorbancias, ademas de en cuales sistemas se puede emplear
Recomendaciones de seguridad
Se debe leer el manual de operación del espectrómetro UV-vis a emplear, o recibir instrucción sobre su correcto manejo por parte de personal experto.
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Spectroscopy Based on Absorption
Como citar este artículo:
APA: (2019-09-11). Cuantificación de dos analitos con UV vis empleando el método de adición de absorbancias. Recuperado de https://quimicafacil.net/manual-de-laboratorio/adicion-de-absorbancias/
ACS: . Cuantificación de dos analitos con UV vis empleando el método de adición de absorbancias. https://quimicafacil.net/manual-de-laboratorio/adicion-de-absorbancias/. Fecha de consulta 2024-07-27.
IEEE: , "Cuantificación de dos analitos con UV vis empleando el método de adición de absorbancias," https://quimicafacil.net/manual-de-laboratorio/adicion-de-absorbancias/, fecha de consulta 2024-07-27.
Vancouver: . Cuantificación de dos analitos con UV vis empleando el método de adición de absorbancias. [Internet]. 2019-09-11 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/adicion-de-absorbancias/.
MLA: . "Cuantificación de dos analitos con UV vis empleando el método de adición de absorbancias." https://quimicafacil.net/manual-de-laboratorio/adicion-de-absorbancias/. 2019-09-11. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net