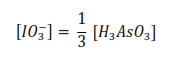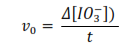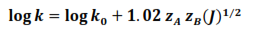Tiempo de lectura estimado: 9 minutos
En 1864, Peter Waage y Cato Guldberg fueron pioneros en el desarrollo de la cinética química al formular la ley de acción de masas, que establece que la velocidad de una reacción química es proporcional a la cantidad de las sustancias que reaccionan.
Van ‘t Hoff estudió la dinámica química y en 1884 publicó sus famosos «Études de dynamique chimique«. En 1901 se le concedió el primer Premio Nobel de Química «en reconocimiento a los extraordinarios servicios que ha prestado por el descubrimiento de las leyes de la dinámica química y de la presión osmótica en las soluciones». Después de Van ‘t Hoff, la cinética química se ocupa de la determinación experimental de las velocidades de reacción a partir de las cuales se derivan las leyes y constantes de velocidad.
Determinación de los parámetros cinéticos de una reacción utilizando el método de las velocidades iniciales de van’t Hoff
En esta práctica de laboratorio se estudia la aplicación del método de las velocidades iniciales a la reacción entre el ión yodato y el ión yoduro en medio ácido:
De manera general, la velocidad de la reacción global se puede escribir de la siguiente forma:
Para la reacción en estudio, se pueden despreciar las concentraciones de los productos. Por lo tanto, la anterior expresión queda:
o sea, en función solamente de los reactivos, donde a, b y c son los órdenes parciales respecto a cada especie.
De los métodos que se utilizan con mayor frecuencia para el análisis de datos experimentales, uno de los más utilizados es el método de las velocidades iniciales de van’t Hoff. Este método trabaja con valores de velocidades y concentraciones en condiciones iniciales.
En esta práctica se determinan las velocidades iniciales utilizando una reacción que indirectamente permite hallar la variación de la concentración de la sustancia reaccionante en un intervalo de tiempo. Esta debe ser más rápida que la estudiada, para lo cual se utiliza la reacción entre el ion triyoduro y el ácido arsenioso:
Según esta reacción cuando todo el ácido arsenioso añadido se consume, los iones triyoduros quedan libres. Si al sistema reaccionante se le añade previamente almidón, estos iones triyoduro forman un complejo con el mismo que otorga a la disolución un color azul característico.
La reacción global resultante es
Según la reacción estequiométrica, cuando se ha consumido todo el ácido, se ha transformado una concentración de yodato igual a la tercera parte de la concentración del ácido, lo que transforma genera la siguiente relación
De esta manera, las velocidades iniciales se hallan conociendo la variación de concentración de yodato por la relación estequiométrica anterior y conociendo el tiempo en que varía la concentración de yodato por el tiempo que demora en aparecer la coloración azul del complejo triyoduro-almidón:
La reacción que se estudia es entre iones por lo que debe tenerse en cuenta la influencia de la fuerza iónica sobre las constantes de velocidad y consecuentemente, sobre las constantes empíricas. La ecuación de Bröensted-Bjerrum relaciona la constante de velocidad de una reacción química como función de la fuerza iónica de la siguiente manera
Donde
- K es la constante de velocidad específica
- K0 es la constante de velocidad específica a dilución infinita
- ZA y ZB son las cargas de los iones reaccionantes
Y J es la fuerza iónica calculada de la forma
Donde Ci es la molaridad de los iones y Zi es la carga de los iones i
Materiales
- Balón aforado de 1000 mL
- Balón aforado de 500 mL
- Probeta de 1000 mL
- Beaker o vaso de precipitados de 1000 mL
- 4 Beaker o vasos de precipitados de 150 mL
- 3 pipetas aforadas de 20 mL
- 3 pipetas graduadas de 50 mL
- Vidrios de reloj
- Balanza analítica
- Cronometro
Reactivos
- Acetato de sodio trihidratado
- Ácido acético glacial
- Almidón
- Arsenito de sodio
- Yodato de potasio
- Yoduro de potasio
- Yoduro de mercurio (II)
Procedimiento
Preparar las siguientes soluciones
Disolución 0.75 M de acetato de sodio: Pesar 102.06 g de acetato de sodio trihidratado y colocar en balón aforado de 1 L. llevar a volumen.
Disolución 0.22 M de ácido acético: Medir 6.4 mL de ácido acético glacial (densidad = 1.049 g/mL) y llevar a balón aforado de 500 mL. Llevar a volumen.
Disolución 0.2 % de almidón: Pesar aproximadamente 2 g de almidón y disolver en 1 L de agua, con calentamiento, hasta disolución total. Añadir yoduro de mercurio (II) en pequeña cantidad, para preservar el almidón.
Buffer A: Tomar 100 mL de disolución 0.75 M de acetato de sodio, 100 mL de disolución 0.22 M de ácido acético y 20 mL de disolución 0.2 % de almidón. Colocar en balón aforado de 500 mL. Llevar a volumen.
Buffer B: Tomar 50 mL de disolución 0.75 M de acetato de sodio, 100 mL de disolución 0.22 M de ácido acético, 10 mL de disolución 0.2% almidón. Colocar en balón aforado de 250 mL. Llevar a volumen.
Disolución 0.03 M de ácido arsenioso: Pesar 3.89 g de arsenito de sodio para 1 L de disolución. Regular el pH a 5.
Disolución 0.1 M de yodato de potasio: Pesar 10.7 g de yodato de potasio y colocar en balón aforado de 500 mL. Llevar a volumen.
Disolución 0.2 M de yoduro de potasio (debe ser fresca): Pesar 16.6 g de yodato de potasio y colocar en balón aforado de 500 mL. Llevar a volumen.
Teniendo en cuenta los volúmenes mostrados en la siguiente tabla, preparar 2 beaker. Medir los volúmenes de las disoluciones de ácido arsenioso, yodato y buffer, indicados para cada experiencia en el cuadro anterior. Mezclar en el beaker A.
Medir el volumen de la disolución de yoduro indicado para cada par y conservar en el beaker B.
Mezclar el contenido de ambos beaker (indistintamente A en B o B en A) y poner en funcionamiento el cronometro. Detener el cronómetro al aparecer los primeros indicios de coloración azul del complejo triyoduro-almidón. Anotar la lectura del tiempo tomada con el cronómetro en el cuadro preparado.
Después del laboratorio
Cálculo de las velocidades iniciales
Las velocidades iniciales se hallan conociendo la variación de la concentración de yodato por la relación estequiométrica y conociendo el tiempo en que varía la concentración de yodato por el tiempo que demora en aparecer la coloración azul del complejo triyoduro-almidón.
Cálculo de las concentraciones iniciales
El cálculo de las concentraciones de los iones yoduro y yodato se realiza normalmente aplicando la ley de la volumetría para las diferentes condiciones del sistema en estudio.
Es necesario detallar el cálculo de la concentración de H+. En este caso lo que se halla es la concentración H+ de una solución buffer, por lo tanto, es necesario utilizar la relación:
Donde:
- K es la constante de disociación del ácido acético (1.753 ∙ 10-5 mol/L a 25°C)
- γ± es el coeficiente de actividad iónico medio del HAc
- [Ac–] es la concentración de acetato debida al acetato de sodio
- [HAc] es la concentración del ácido acético
Es necesario conocer el coeficiente de actividad iónico medio, que se obtiene de la relación:
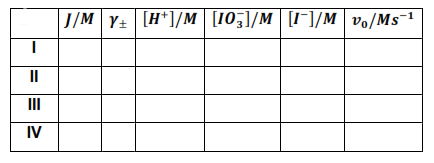
Por lo que es necesario calcular la fuerza iónica de cada especie. Para facilitar los cálculos se puede utilizar la siguiente tabla
Para más información The equilibrium between arsenious acid and iodine in solution
Como citar este artículo:
APA: (2022-04-20). Determinación de los parámetros cinéticos. Recuperado de https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/determinacion-de-los-parametros-cineticos/
ACS: . Determinación de los parámetros cinéticos. https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/determinacion-de-los-parametros-cineticos/. Fecha de consulta 2024-07-27.
IEEE: , "Determinación de los parámetros cinéticos," https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/determinacion-de-los-parametros-cineticos/, fecha de consulta 2024-07-27.
Vancouver: . Determinación de los parámetros cinéticos. [Internet]. 2022-04-20 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/determinacion-de-los-parametros-cineticos/.
MLA: . "Determinación de los parámetros cinéticos." https://quimicafacil.net/manual-de-laboratorio/fisicoquimica/determinacion-de-los-parametros-cineticos/. 2022-04-20. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net