Tiempo de lectura estimado: 8 minutos
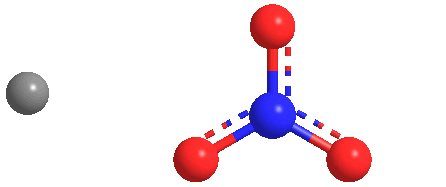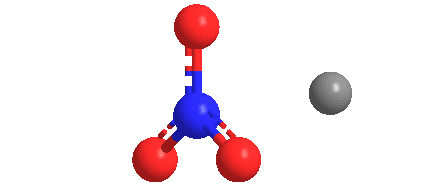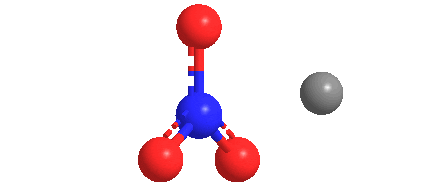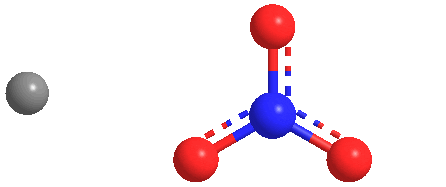
El nitrato de sodio es un compuesto químico con la fórmula NaNO3. Esta sal alcalina de nitrato metálico es también conocida como salitre de Chile (grandes depósitos de este compuesto fueron históricamente minados en Chile) para distinguirla del salitre común, el nitrato de potasio. La forma mineral es también conocida como nitratina, nitratita o nitrato de soda.
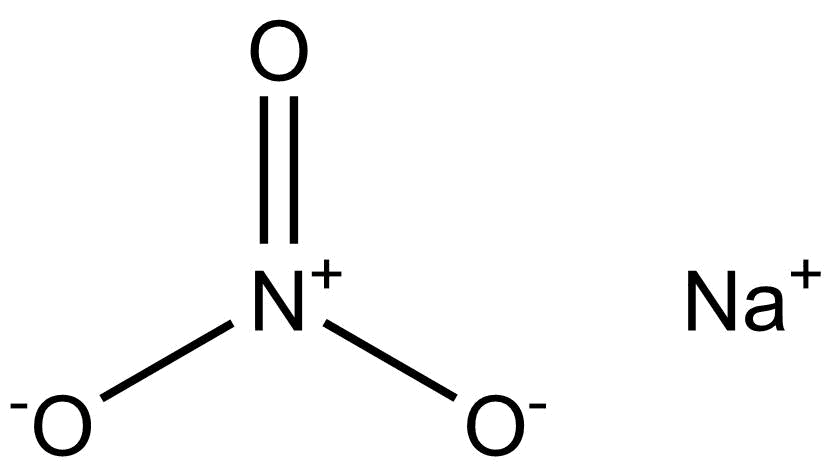
El nitrato de sodio es un sólido blanco muy soluble en agua. Es una fuente fácilmente disponible del anión nitrato (NO3-), que es útil en varias reacciones llevadas a cabo a escala industrial para la producción de fertilizantes, pirotecnia y bombas de humo, esmaltes para vidrio y cerámica, conservantes de alimentos (especialmente carnes), y propulsor sólido para cohetes. Se ha minado extensamente para estos fines.
Historia del nitrato de sodio
El primer embarque de salitre peruano a Europa llegó a Inglaterra en 1820 o 1825, justo después de la independencia de ese país de España, pero no encontró compradores y fue arrojado al mar para evitar el pago de aranceles.
Con el tiempo, sin embargo, la extracción de salitre sudamericano se convirtió en un negocio rentable (en 1859, sólo Inglaterra consumió 47,000 toneladas métricas). Chile luchó en la Guerra del Pacífico (1879-1884) contra los aliados Perú y Bolivia y se apoderó de sus más ricos depósitos de salitre. En 1919, Ralph Walter Graystone Wyckoff determinó su estructura cristalina usando cristalografía de rayos X.
Durante más de un siglo, el suministro mundial del compuesto se extrajo casi exclusivamente del desierto de Atacama, en el norte de Chile, hasta que, a principios del siglo XX, los químicos alemanes Fritz Haber y Carl Bosch desarrollaron un proceso para producir amoníaco a partir de la atmósfera a escala industrial (proceso de Haber).

Con el inicio de la Primera Guerra Mundial, Alemania comenzó a convertir el amoníaco de este proceso en un salitre de Chile sintético, que era tan práctico como el compuesto natural en la producción de pólvora y otras municiones. En la década de 1940, este proceso de conversión resultó en una dramática disminución de la demanda de nitrato de sodio obtenido de fuentes naturales.
Minas de salitre de Chile
Las mayores acumulaciones de nitrato de sodio que ocurren naturalmente se encuentran en Chile y Perú, donde las sales de nitrato se unen dentro de depósitos minerales llamados mineral de caliche.
Los nitratos se acumulan en la tierra a través de la precipitación de la niebla marina y la oxidación/desecación de la pulverización marina seguida por el asentamiento gravitacional de NaNO3, KNO3, NaCl, Na2SO4, y en la atmósfera caliente y seca del desierto.

Los ciclos de aridez extrema/lluvia torrencial debidos a los fenómenos meteorológicos de El Niño/La Niña favorecen la acumulación de nitratos tanto a través de la aridez como de la solución/removilización/transporte de agua en las laderas y en las cuencas; el movimiento capilar de la solución forma capas de nitratos; el nitrato puro forma venas.
Chile aún tiene las mayores reservas de caliche, con minas activas en lugares como Pedro de Valdivia, María Elena y Pampa Blanca, y allí solía llamarse oro blanco a los compuestos Nitrato de sodio, nitrato de potasio, sulfato de sodio y yodo, todos obtenidos por el procesamiento del caliche. Las antiguas comunidades mineras salitreras chilenas de Humberstone y Santa Laura fueron declaradas Patrimonio de la Humanidad por la Unesco en 2005.
Síntesis del nitrato de sodio
El nitrato de sodio también se sintetiza industrialmente mediante la neutralización del ácido nítrico con carbonato de sodio o bicarbonato de sodio:

o también neutralizándolo con hidróxido de sodio (sin embargo, esta reacción es muy exotérmica):

o mezclando cantidades estequiométricas de nitrato de amonio e hidróxido de sodio, bicarbonato de sodio o carbonato de sodio:
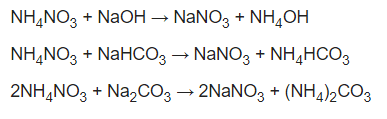
Usos del nitrato de sodio
El nitrato de sodio puede combinarse con ácido sulfúrico y ácido nítrico destilado. A menor presión, la menor temperatura necesaria resulta en una menor descomposición. Los teóricos 2 moles de ácido nítrico por 1 mol de ácido sulfúrico dan como resultado una temperatura final muy alta, mucha descomposición y un sulfato neutro sólido difícil de eliminar. Cuando esta reacción era importante industrialmente, era una práctica común operar con ácido sulfúrico en exceso para terminar en un producto mayormente de bisulfato vertido fundido.
Los refinadores de oro aficionados usan nitrato de sodio para hacer un híbrido de aqua regia que disuelve el oro y otros metales.
Aplicaciones menos comunes incluyen como oxidante en fuegos artificiales, reemplazando el nitrato de potasio que se encuentra comúnmente en la pólvora, y como componente en los empaques fríos instantáneos.
El nitrato de sodio se utiliza junto con el nitrato de potasio y el nitrato de calcio para el almacenamiento de calor y, más recientemente, para la transferencia de calor en las plantas de energía solar.
Una mezcla de nitrato de sodio, nitrato de calcio y nitrato de potasio se utiliza como material de almacenamiento de energía en plantas prototipo, tales como la Central Solar Andasol y el proyecto Arquímedes.
También se utiliza en la industria de aguas residuales para la respiración facultativa de microorganismos. Nitrosomonas, un género de microorganismos consume nitrato en lugar de oxígeno, lo que permite que crezca más rápidamente en las aguas residuales a tratar.
El nitrato de sodio también es utilizado a veces por acuaristas marinos que utilizan técnicas de dosificación de carbono. Se utiliza para aumentar los niveles de nitrato en el agua y promover el crecimiento bacteriano.
El nitrato de sodio es también un aditivo alimentario utilizado como conservante y fijador del color en las carnes curadas y las aves de corral; figura con el número SIN 251 o el número E251. Está aprobado para su uso en la UE, EE. UU., Australia y Nueva Zelandia. El nitrato de sodio no debe confundirse con el nitrito de sodio, que es también un aditivo alimentario y conservante común utilizado, por ejemplo, en las carnes frías.
Preocupaciones sobre el uso de nitrato de sodio
Los estudios han demostrado un vínculo entre el aumento de los niveles de nitratos y el aumento de las muertes por ciertas enfermedades, incluyendo la enfermedad de Alzheimer, la diabetes mellitus, el cáncer de estómago y la enfermedad de Parkinson: posiblemente a través del efecto perjudicial de las nitrosaminas en el ADN, sin embargo, se hace poco para controlar otras posibles causas en los resultados epidemiológicos.
Las nitrosaminas, que se forman en los embutidos que contienen nitrato y nitrito de sodio, se han relacionado con el cáncer gástrico y el cáncer de esófago. El nitrato y el nitrito de sodio se relacionan con un mayor riesgo de cáncer colorrectal.
Una de las razones por las que la carne procesada aumenta el riesgo de cáncer de colon es su contenido de nitrato. Una pequeña cantidad del nitrato que se añade a la carne como conservante se descompone en nitrito, además de cualquier nitrito que también se pueda añadir. El nitrito entonces reacciona con alimentos ricos en proteínas (como la carne) para producir NOCs (compuestos nitrosos) cancerígenos. Los NOC pueden formarse cuando la carne se cura o en el cuerpo cuando se digiere la carne.
Para más información Sodium Nitrate – ScienceDirect.com
Como citar este artículo:
APA: (2020-06-23). Nitrato de sodio. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/nitrato-de-sodio/
ACS: . Nitrato de sodio. https://quimicafacil.net/compuesto-de-la-semana/nitrato-de-sodio/. Fecha de consulta 2025-07-06.
IEEE: , "Nitrato de sodio," https://quimicafacil.net/compuesto-de-la-semana/nitrato-de-sodio/, fecha de consulta 2025-07-06.
Vancouver: . Nitrato de sodio. [Internet]. 2020-06-23 [citado 2025-07-06]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/nitrato-de-sodio/.
MLA: . "Nitrato de sodio." https://quimicafacil.net/compuesto-de-la-semana/nitrato-de-sodio/. 2020-06-23. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net