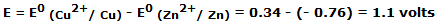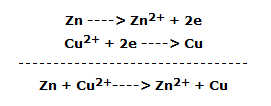Tiempo de lectura estimado: 7 minutos
La pila de Daniell es un tipo de pila electroquímica inventada en 1836 por John Frederic Daniell, químico y meteorólogo británico, y consistía en una olla de cobre llena de una solución de sulfato de cobre (II), en la que se sumerge un recipiente de barro sin esmaltar lleno de ácido sulfúrico y un electrodo de zinc.
Buscaba una forma de eliminar el problema de las burbujas de hidrógeno que se encontraban en la pila voltaica, y su solución fue utilizar un segundo electrolito para consumir el hidrógeno producido por el primero. El ácido sulfúrico puede ser sustituido por sulfato de zinc.
La pila de Daniell supuso una gran mejora respecto a la tecnología existente en los primeros tiempos del desarrollo de las pilas. Una variante posterior de la pila de Daniell, llamada pila de gravedad o pila de crowfoot , fue inventada en la década de 1860 por un francés llamado Callaud y se convirtió en una opción popular para la telegrafía eléctrica.
La célula de Daniell es también la base histórica de la definición actual del voltio, que es la unidad de fuerza electromotriz en el Sistema Internacional de Unidades. Las definiciones de las unidades eléctricas que se propusieron en la Conferencia Internacional de Electricistas de 1881 se diseñaron para que la fuerza electromotriz de la célula Daniell fuera de aproximadamente 1,0 voltios. Con las definiciones actuales, el potencial estándar de la célula Daniell a 25 °C es en realidad de 1,10 V.
Oxidorreducción en la pila de Daniell
La oxidación-reducción consiste en un flujo de electrones desde el elemento menos electronegativo hacia el más electronegativo; este flujo no es más que energía eléctrica. Si separamos las dos semirreacciones de forma que el flujo de electrones siga una trayectoria exterior al sistema de reacción, es posible transformar la energía en trabajo.
El trabajo realizado por el flujo de electrones se denomina f.e.m. (fuerza electromotriz) o potencial eléctrico.
Los sistemas que transforman un redox en un potencial se denominan células o pilas electroquímicas.
Una pila consta de dos elementos galvánicos (semiceldas), cada uno de ellos formado por una lámina metálica sumergida en una solución salina del mismo metal.
Los dos elementos están conectados por un puente de sal (un tubo en forma de U que contiene una solución concentrada, por ejemplo, de KNO3 o NH4Cl) que permite la migración de los iones con el fin de mantener las soluciones eléctricamente neutras sin la mezcla completa de las mismas; esta eventualidad permitiría, de hecho, que los iones intercambiaran electrones directamente por contacto sin generar ninguna f.e.m. El puente de sal puede ser sustituido por un tabique poroso con la misma función.
Las dos placas metálicas están conectadas con cables eléctricos a un circuito externo que incluye un usuario, normalmente un voltímetro o un multímetro. En el circuito los electrones pasarán partiendo del electrodo que más tiene, que es el de la semicelda donde se produce la oxidación (ánodo o polo negativo), para llegar al electrodo de la semicelda donde se produce la reducción (cátodo o polo positivo). Mediante el voltímetro o el multímetro es posible medir la f.e.m. generada.
Cuando el sistema alcanza el equilibrio, el proceso se completa.
Potencial estándar (E0): es el potencial de un redox que tiene lugar a 25 °C y a 1 atm. entre un electrodo de cualquier metal en una solución 1 M de una de sus sales y un electrodo de hidrógeno.
Materiales
- 3 vasos de precipitados de 200 mL
- Tubo en U de vidrio
- Probeta graduada de 100 mL
- Multímetro
- Cables de conexión
- Algodón
Reactivos
- Láminas de cobre, zinc, magnesio
- Soluciones 0,1 M de sulfato de cobre (II), sulfato de zinc, sulfato de magnesio
- Solución concentrada de cloruro de amonio
Procedimiento – Pila de Daniell
Parte 1: Celda de Zn // Cu:
Poner en un vaso de precipitados unos 100 mL de solución de sulfato de cobre 0,1 M sumergiendo la lámina de cobre. En un segundo vaso de precipitados pon una cantidad idéntica de solución de sulfato de zinc 0,1 M sumergiendo la lámina de zinc. Conecta la lámina de cobre a la entrada positiva del voltímetro y la lámina de zinc a la entrada negativa mediante dos cables de distinto color.
El tubo en forma de U se llena completamente con una solución concentrada de cloruro de amonio, tapando los dos extremos con dos bolas de algodón; el tubo sirve, como se ha dicho, de puente salino.
Da la vuelta al puente salino, comprobando que hay continuidad en la solución dentro del tubo en U, y sumergir cada extremo del tubo en los dos vasos de precipitados. Si todo se ha hecho correctamente, en el voltímetro podemos observar una f.e.m. de unos 1,1 voltios.
Esta f.e.m. viene dada por la diferencia entre los potenciales de los dos electrodos:
La reacción de oxidación-reducción que se produjo es la siguiente:
El zinc funciona como ánodo (polo negativo) y, por tanto, se oxida consumiéndose, mientras que el cobre funciona como cátodo (polo positivo) reduciéndose y, por tanto, aumentando su volumen.
Si tenemos un amperímetro o un multímetro, conectándolo en lugar del voltímetro, es posible medir la intensidad de la corriente.
Segunda parte: Celda Mg // Cu:
Proceder como en el siguiente paso, sustituyendo el vaso de la media pila de Zn por un vaso que contenga unos 100 mL de solución de sulfato de magnesio 0,1 M y sumergiendo una lámina de magnesio.
Se observará un f.e.m. de unos 2,71 voltios.
Esta f.e.m. viene dada por la diferencia entre los potenciales de los dos electrodos:
La reacción de oxidación-reducción que se produce es la siguiente:
El magnesio funciona como ánodo (polo negativo) y, por tanto, se oxida consumiéndose, mientras que el cobre funciona como cátodo (polo positivo) reduciéndose y, por tanto, aumentando su volumen.
También en este caso es posible medir la intensidad de la corriente con la ayuda de un amperímetro.
Despues del experimento
Consultar los potenciales de media celda de cada una de las semirreacciones involucradas y confirmar el valor del voltaje obtenido con el valor teorico.
Para más información Daniell Cell
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Como citar este artículo:
APA: (2021-04-14). Pila de Daniell. Recuperado de https://quimicafacil.net/manual-de-laboratorio/pila-de-daniell/
ACS: . Pila de Daniell. https://quimicafacil.net/manual-de-laboratorio/pila-de-daniell/. Fecha de consulta 2025-07-06.
IEEE: , "Pila de Daniell," https://quimicafacil.net/manual-de-laboratorio/pila-de-daniell/, fecha de consulta 2025-07-06.
Vancouver: . Pila de Daniell. [Internet]. 2021-04-14 [citado 2025-07-06]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/pila-de-daniell/.
MLA: . "Pila de Daniell." https://quimicafacil.net/manual-de-laboratorio/pila-de-daniell/. 2021-04-14. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net