Actualizado en enero 9, 2024
Tiempo de lectura estimado: 6 minutos
El ciclo del cobre es uno de los ensayos más interesantes en química inorgánica gracias a la versatilidad del cobre para formar muchos compuestos.
El cobre es un elemento metálico que desempeña un papel fundamental en la química inorgánica, especialmente en el laboratorio, debido a su capacidad para formar una amplia variedad de compuestos. El ciclo del cobre, un ensayo de gran interés en química inorgánica, involucra una serie de reacciones que permiten observar las propiedades químicas y los estados de oxidación del cobre.
Este ciclo experimental, que incluye la manipulación de reactivos como ácido nítrico, zinc metálico y otros, proporciona una comprensión profunda de las características del cobre y su comportamiento en diversas reacciones, lo que lo convierte en una práctica fundamental en el laboratorio de química inorgánica.
Química del ciclo del cobre
El principal uso del cobre es el de conductor de la electricidad, gracias a su alta conductividad, ductilidad y maleabilidad, se pueden elaborar cables de diversos calibres para transporte de corriente eléctrica.
También es capaz de formar una gran cantidad de aleaciones, como bronces y latones. También tiene un excelente índice de recuperación, pudiéndose ser reciclado un numero casi ilimitado de veces.
El cobre fue uno de los primeros materiales metálicos conocidos y manejados por la humanidad. La aleación del cobre con estaño, llamada bronce, fue el material por excelencia para la elaboración de utensilios y armas durante la edad del Bronce.
Luego del desarrollo de la siderúrgica y el uso del hierro y sus aleaciones, el uso del cobre bajó, pero su conductividad eléctrica lo hizo retomar un papel de importancia en el siglo XIX con la expansión del uso de la energía eléctrica.
El cobre también tiene un papel importante en procesos biológicos en plantas y animales y se encuentra en muchos alimentos habituales consumidos por el ser humano, por lo cual es rara la deficiencia en este mineral.
Desde un punto de vista químico, el cobre presenta primordialmente dos estados de oxidación: +1 y +2. El elemento metálico expuesto al aire forma rápidamente una capa de oxido cuproso u oxido de cobre (I). pasado el tiempo, el oxido cuproso pasa a ser oxido cúprico u oxido de cobre (II), de color oscuro. Si hay alta humedad, puede observarse la formación de carbonato cúprico, sustancia de color verde y toxica.
Una reacción de interés es la formación de cardenillo, mezcla venenosa de los acetatos de cobre de tonos verde – azulados, que se genera al emplear vinagre (acido acético) en recipientes de cobre. El cobre exhibe una alta reactividad y sus reacciones son diversas.
Una propiedad interesante del cobre es la capacidad de formar aleaciones. Las aleaciones mas empleadas son el latón (cobre – zinc), bronce (Cu- Sn), alpaca (Cu-Ni-Zn), monel (Cu-Ni-Fe). Además, existen otras aleaciones con cadmio, cromo, fosforo, aluminio, berilio, plata y manganeso.
Materiales
- Vasos de precipitados de 100 y 250mL
- Probetas de 15 y 100 mL
- Embudo de vidrio
- Papel filtro
- Pipeta graduada de 10 mL
- Agitador de vidrio
- Soporte universal
- Sistema de filtración al vacío con Embudo Buchner
- Vidrio de reloj
- Balanza analítica
Reactivos
- Cobre metálico
- Zinc metálico
- Ácido nítrico concentrado
- Solución de hidróxido de sodio 3 M
- Ácido sulfúrico 6 M
- Ácido clorhídrico 6 M
Procedimiento – Ciclo del cobre
A lo largo de la práctica, anotar las observaciones que se puedan realizar sobre las reacciones (generación de calor, desprendimiento de gases, colores de las soluciones, precipitados, gases, etc.)
Tiempo necesario: 1 hora y 30 minutos
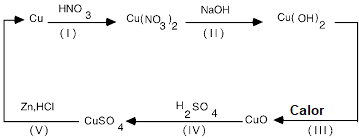
Ciclo del cobre
Pesar 0.5 g de cobre metálico y colocarlos en un vaso de precipitados de 250 mL. En una campana de extracción de gases añadir 4 mL de ácido nítrico concentrado y agitar con ayuda de la varilla de agitación. Mantener el vaso de precipitados en la campana de extracción hasta observar que no desprende más gas.
Al vaso de precipitados, añadir 125 mL de agua destilada y homogenizar. Manteniendo la agitación agregar 30 mL de solución de hidróxido de sodio 3 M. Calentar suavemente para estimular la reacción.
Calentar hasta observar la formación de un precipitado. Decantar el precipitado y añadir 200 mL de agua destilada, lavar y dejar reposar. Retirar el liquido procurando no perder el sólido.
Al precipitado obtenido, adicionar 15 mL de ácido sulfúrico 6 M y agitar hasta disolver todo el precipitado.
AnuncioEn una campana de extracción de gases añadir 2 g de zinc metálico y agitar hasta que la solución sea incolora, esperar a que cese el desprendimiento de gas.
Si se observa que queda algo de zinc, añadir 10 mL de ácido clorhídrico 6 M y calentar sin llegar a ebullición. Cuando cese la reacción, recuperar el cobre formado a través de filtración al vacío. Dejar secar en un desecador y pesar.
Después del experimento
Identificar las reacciones llevadas a cabo en la práctica, teniendo en cuenta las observaciones físicas realizadas. Escribir las ecuaciones balanceadas correspondientes y realizar el cálculo estequiométrico correspondiente a cada etapa asumiendo un rendimiento del 100 % en cada reacción.
Realizar un diagrama de reacción correspondiente al ciclo del cobre trabajado en la práctica y comparar con el presentado.
Comparar la cantidad de cobre obtenido con la cantidad teórica calculada por estequiometria y calcular el índice de recuperación del cobre en la práctica.
El índice de recuperación se puede calcular dividiendo la masa de cobre obtenida en valor de masa calculado y multiplicar por 100. ¿Como se puede explicar la perdida o ganancia de masa de cobre según sea el caso?
Recomendaciones de seguridad
En la práctica se pueden generar gases tóxicos, por lo tanto, las reacciones deben ser llevadas a cabo en campana de extracción de gases.
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Más información Copper Cycle
Como citar este artículo:
APA: (2019-06-26). Ciclo del cobre. Recuperado de https://quimicafacil.net/manual-de-laboratorio/ciclo-del-cobre/
ACS: . Ciclo del cobre. https://quimicafacil.net/manual-de-laboratorio/ciclo-del-cobre/. Fecha de consulta 2024-07-27.
IEEE: , "Ciclo del cobre," https://quimicafacil.net/manual-de-laboratorio/ciclo-del-cobre/, fecha de consulta 2024-07-27.
Vancouver: . Ciclo del cobre. [Internet]. 2019-06-26 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/ciclo-del-cobre/.
MLA: . "Ciclo del cobre." https://quimicafacil.net/manual-de-laboratorio/ciclo-del-cobre/. 2019-06-26. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net