Tiempo de lectura estimado: 23 minutos
Elias James Corey, llamado tambien «E.J.» Corey (nacido el 12 de julio de 1928) es un químico orgánico estadounidense. En 1990, ganó el Premio Nobel de Química «por su desarrollo de la teoría y la metodología de la síntesis orgánica», específicamente el análisis retrosintético. Considerado por muchos como uno de los más grandes químicos vivos, ha desarrollado numerosos reactivos sintéticos, metodologías y síntesis totales y ha avanzado considerablemente en la ciencia de la síntesis orgánica.

Biografía resumida de Elias James Corey
E.J. Corey (el apellido fue anglicizado del árabe libanés Khoury, que significa sacerdote) nació de inmigrantes libaneses cristianos en Methuen, Massachusetts, a 50 km (31 mi) al norte de Boston. Su madre le cambió el nombre a «Elías» para honrar a su padre, que murió dieciocho meses después del nacimiento de Corey. Su madre viuda, su hermano, dos hermanas y una tía y un tío vivieron juntos en una casa espaciosa, luchando a través de la Gran Depresión. De joven, Corey era independiente y disfrutaba de deportes como el béisbol, el fútbol y el senderismo. Asistió a una escuela primaria católica y a la Escuela Secundaria de Lawrence en Lawrence, Massachusetts.
A la edad de 16 años, Corey entró en el MIT, donde obtuvo una licenciatura en 1948 y un doctorado con el profesor John C. Sheehan en 1951. Al entrar en el MIT, la única experiencia de Corey con la ciencia fue en matemáticas, y comenzó su carrera universitaria persiguiendo un título en ingeniería. Después de su primera clase de química en su segundo año, comenzó a replantearse sus planes de carrera a largo plazo y se graduó con una licenciatura en química.

Inmediatamente después, por invitación del profesor John C. Sheehan, Corey permaneció en el MIT para su doctorado. Después de su carrera de posgrado se le ofreció un nombramiento en la Universidad de Illinois en Urbana-Champaign, donde se convirtió en profesor titular de química en 1956 a la edad de 27 años. Se inició como miembro del capítulo Zeta de Alpha Chi Sigma en la Universidad de Illinois en 1952. En 1959, se trasladó a la Universidad de Harvard, donde actualmente es profesor emérito de química orgánica con un activo programa de investigación del Grupo Corey. Eligió trabajar en química orgánica debido a «su belleza intrínseca y su gran relevancia para la salud humana» También ha sido asesor de Pfizer durante más de 50 años.
Entre numerosos honores, Corey recibió la Medalla Nacional de Ciencia en 1988, el Premio Nobel de Química en 1990, y el mayor honor de la Sociedad Americana de Química, la Medalla Priestley, en 2004
Principales contribuciones de E.J. Corey a la química
Reactivos
Elias James Corey ha desarrollado varios nuevos reactivos sintéticos:
- El PCC (clorocromato de piridinio), también conocido como reactivo Corey-Suggs, se utiliza ampliamente para la oxidación de alcoholes a las cetonas y aldehídos correspondientes. El PCC tiene varias ventajas sobre otros oxidantes comerciales.
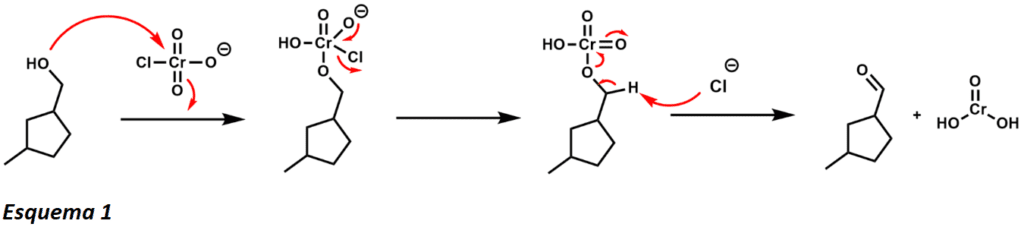
Una de estas ventajas es que el compuesto está disponible como un sólido amarillo estable al aire que no es muy higroscópico. A diferencia de otros agentes oxidantes, el PCC puede realizar oxidaciones simples con sólo unos 1,5 equivalentes (esquema 1). El alcohol realiza un ataque nucleófilo al metal de cromo(VI) electropositivo desplazando al cloro. El anión cloruro actúa entonces como base para proporcionar el producto aldehído y el cromo(IV). El carácter ligeramente ácido del PCC lo hace útil para las reacciones de ciclización con alcoholes y alquenos (Esquema 2)
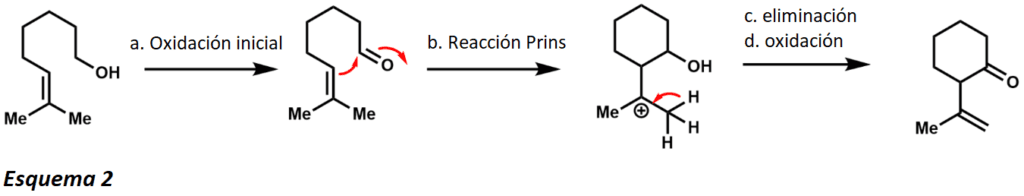
La oxidación inicial produce el aldehído correspondiente, que puede entonces sufrir una reacción de Prins con el alqueno vecino. Después de la eliminación y posterior oxidación, el producto es una cetona cíclica. Si este producto no es deseado, puede utilizarse acetato de sodio en polvo como tampón para lograr sólo la oxidación inicial. La robustez del PCC como agente oxidante también lo ha hecho útil en el ámbito de la síntesis total (Esquema 3). Este ejemplo ilustra que el PCC es capaz de realizar un reordenamiento oxidativo de Dauben con alcoholes terciarios mediante un reordenamiento [3,3]-sigmatrópico.

t-Butildimetilsilil éter (TBS), triisopropilsil éter (TIPS), y metoxietoximetil (MEM): son grupos populares de protección del alcohol. El desarrollo de estos grupos protectores permitió la síntesis de varios productos naturales que no tenían la compatibilidad de grupo funcional para soportar transformaciones químicas estándar. Aunque la comunidad de sintéticos se está alejando ahora del uso de los grupos protectores, sigue siendo raro que una síntesis publicada de un producto natural los omita.
Desde 1972 el grupo TBS se ha convertido en el grupo protector de silicio más popular. El TBS es estable a la cromatografía y lo suficientemente lábil para la ruptura en condiciones básicas y ácidas. Más importante aún, los éteres de TBS son estables a algunos nucleófilos de carbono como los reactivos y enolatos de Grignard.
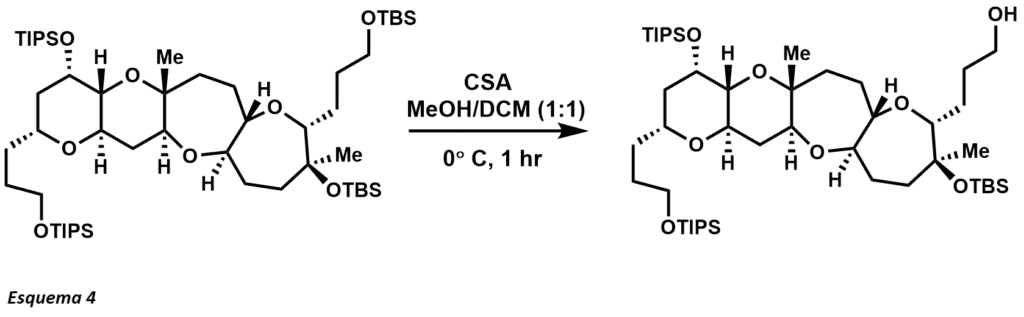
En el campo de la síntesis de moléculas complejas, el STC ha sido ampliamente utilizado como uno de los más versátiles de los grupos protectores basados en el silicio (esquema 4). El uso del STC proporciona la eliminación selectiva de un éter primario de STC en presencia de éter terciario de STC y éteres TIPS. Otros medios de desprotección del TBS incluyen ácidos (también ácidos de Lewis), y fluoruros. Los grupos de protección TIPS también fueron pioneros por Corey y proporcionan una mayor selectividad de la protección primaria contra el alcohol sobre la protección secundaria y terciaria contra el alcohol. Los éteres TIPS son más estables bajo condiciones ácidas y básicas, la desventaja de este grupo protector sobre los éteres TBS es que el grupo es menos lábil para la desprotecció. Los reactivos más comunes utilizados para la separación emplean las mismas condiciones que el éter TBS, pero generalmente se necesitan tiempos de reacción más largos.

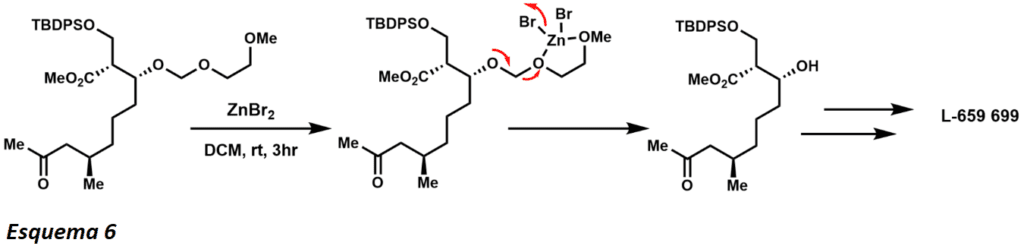
Normalmente los éteres TBS son cortados por el TBAF, pero el éter TBS obstaculizado arriba sobrevive a las condiciones de reacción tras la remoción primaria del TIPS (esquema 5). El grupo protector del MEM fue descrito por primera vez por Corey en 1976. Este grupo protector es similar en reactividad y estabilidad a otros éteres metílicos alcóxicos bajo condiciones ácidas. La división de los grupos protectores del MEM se realiza normalmente en condiciones ácidas, pero la coordinación con los haluros metálicos mejora enormemente la capacidad de división mediante la división asistida (esquema 6).
Los 1,3-Ditianos fueron iniciados por E.J. Corey en 1965 como una modificación temporal de un grupo carbonilo en reacciones de desplazamiento y adición. La formación de ditianos fue el desarrollo inicial que introdujo la química de Umpolung y se utiliza ampliamente para la inversión de la reactividad. Las formaciones de ditianos pueden realizarse con un ácido de Lewis (esquema 7) o directamente a partir de compuestos carbonilos.
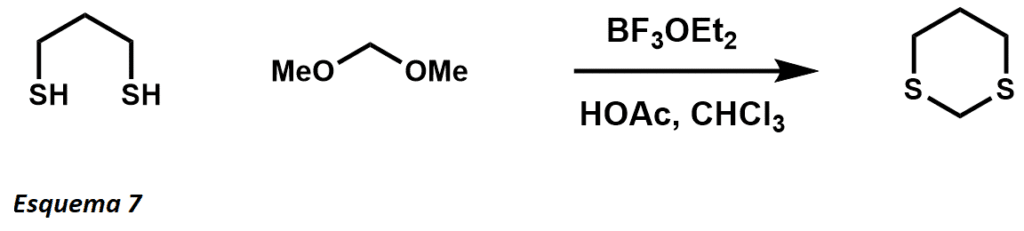
La pKa de los ditianos es de aproximadamente 30, lo que permite la desprotonación con un reactivo de alquilo de litio, típicamente n-butilitio. La reacción con ditianos y aldehídos se conoce ahora como la reacción de Corey-Seebach. El ditiano, una vez desprotonado, sirve como anión acílico usado para atacar a los electrofilos entrantes.
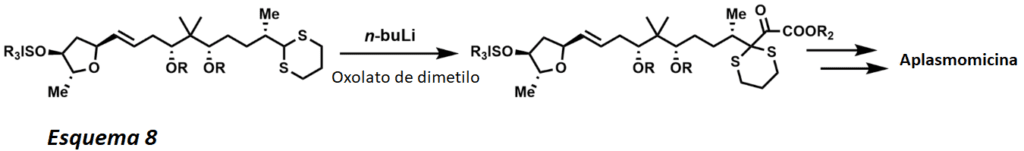
Después de la desprotección del ditiano, normalmente con HgO, se observa un producto cetónico del anión ditiano acílico enmascarado. La utilidad de tales reacciones ha ampliado el campo de la síntesis orgánica al permitir a los químicos sintéticos utilizar las desconexiones de Umpolung en la síntesis total (esquema 8). Los 1,3-ditianos también se utilizan como grupos protectores de los compuestos carbonilos, lo que expresa la versatilidad y la utilidad de este grupo funcional.
Además, Corey inició estudios detallados sobre las ciclizaciones de poliolefinas catiónicas utilizadas en la producción enzimática de colesterol a partir de terpenos vegetales más simples. Corey estableció los detalles del notable proceso de ciclización estudiando primero la síntesis biológica de los esteroles a partir del escualeno.
Metodologías
Varias reacciones desarrolladas en el laboratorio de Corey se han convertido en algo común en la química orgánica sintética moderna. Al menos 302 métodos han sido desarrollados en el grupo de Corey desde 1950. Varias reacciones han sido nombradas en su honor:
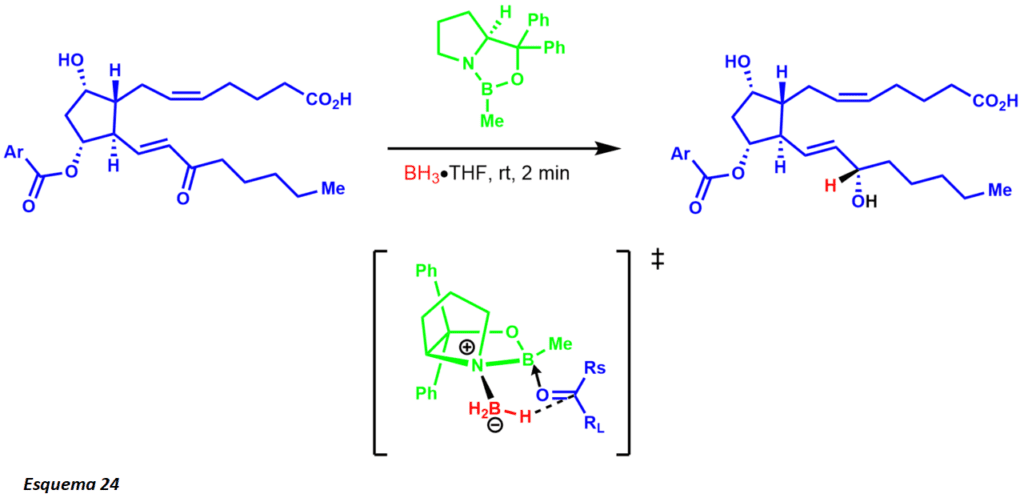
La reducción Corey-Itsuno, también conocida como la reducción Corey-Bakshi-Shibata, es una reducción enantioselectiva de cetonas a alcoholes utilizando un catalizador de oxazaborolidina y varios boranos como reductor estequiométrico. El grupo Corey demostró por primera vez la síntesis del catalizador utilizando borano y aminoalcoholes quirales. La reacción utiliza el aminoácido quiral prolina y en presencia de borano conduce al catalizador CBS (esquema 9).
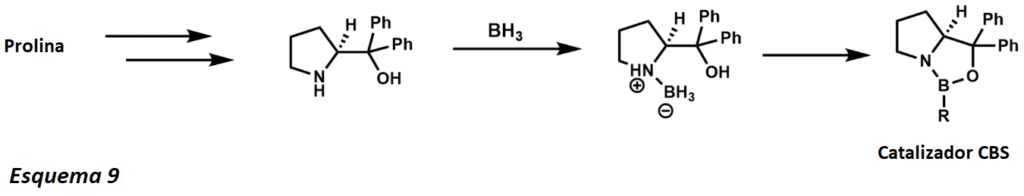
Más tarde, Corey demostró que los boranos sustituidos eran más fáciles de preparar y mucho más estables. El mecanismo de reducción comienza con la oxazoborolidina siendo sólo ligeramente básica en [el nitrógeno], coordinándose con el borano estequiométrico del complejo boro amina (esquema 10). La falta de donación del nitrógeno al boro aumenta su acidez de Lewis, permitiendo la coordinación con el sustrato cetónico. La complejación del sustrato se produce a partir del par solitario más accesible del oxígeno, lo que lleva a una rotación restringida alrededor del enlace B-O debido al grupo de fenilo estericamente vecino.

La migración del hidruro desde el borano al centro de la cetona electrofílica ocurre a través de un estado de transición de anillo de 6 miembros, que lleva a un intermedio de anillo de 4 miembros que finalmente proporciona el producto quiral y la regeneración del catalizador. La reacción también ha sido de gran utilidad para los químicos de productos naturales (esquema 11). La síntesis del disidiolido por Corey y sus colaboradores se logró a través de una reducción enantioselectiva de CBS usando un complejo de borano-dimetilsulfuro.

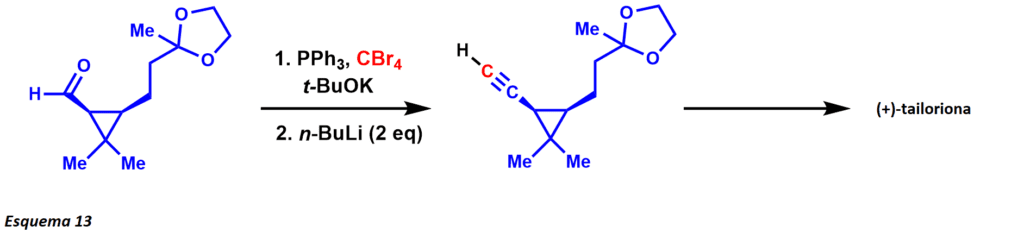
La síntesis de alquinos de Corey-Fuchs es la síntesis de alquinos terminales mediante una homologación de aldehídos de un solo carbono utilizando trifenilfosfina y tetrabromuro de carbono. El mecanismo es similar al de la reacción de Wittig mediante la formación de un ylido de fósforo con trifenilfosfina y tetrabromuro de carbono. La reacción del ylido de fósforo con el sustrato de aldehído produce una dibromoolefina.
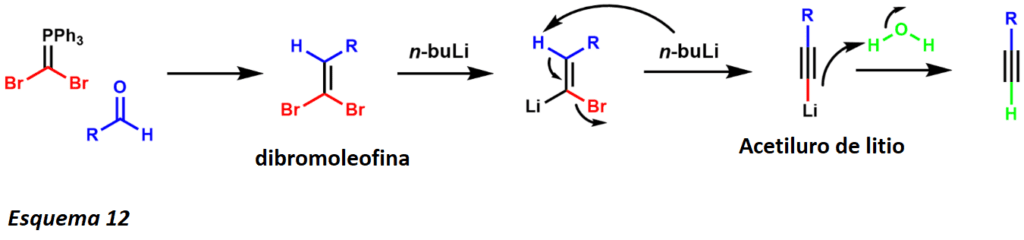
En el tratamiento con dos equivalentes de n-buLi, el intercambio y la deprotonación de litio-halógeno produce una especie de acetiluro de litio que se somete a hidrólisis para obtener el producto alquitranado terminal (esquema 12). Más recientemente, se ha desarrollado una síntesis de un punto utilizando un procedimiento modificado. Esta transformación sintética ha demostrado ser exitosa en la síntesis total (+)-tailoriona por W.J. Kerr y sus colaboradores (esquema 13).
La oxidación de Corey-Kim fue una transformación recientemente desarrollada para la conversión de alcoholes en los aldehídos y cetonas correspondientes. Este proceso ofrece una alternativa menos tóxica a las oxidaciones basadas en el cromo con el uso del cloruro de N-cloro-succinimidosulfonio (NCS), el dimetilsulfuro (DMS) y la trietilamina (TEA). El reactivo Corey-Kim se forma in situ cuando se reacciona con el NCS y el DMS para formar especies de cloruro de dimetilsuccinimidosulfonio (esquema 14).

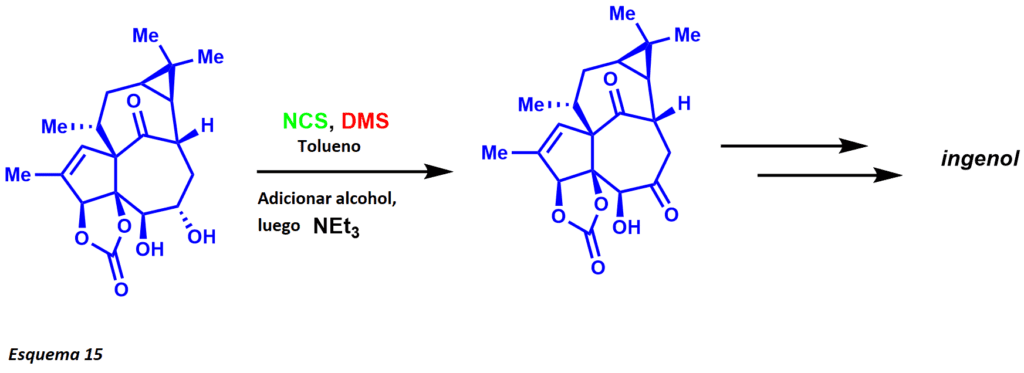
La sal alcóxica de sulfonio se desprotona en la posición alfa con trietilamina para permitir el producto oxidado. La reacción da cabida a una amplia gama de grupos funcionales, pero los alcoholes alílicos y bencílicos se transforman típicamente en cloruros alílicos y bencílicos. Su aplicación en la síntesis se basa en las condiciones del protocolo suave y en la compatibilidad funcional y de protección de los grupos. En la síntesis total del ingenol, Kuwajima y sus colaboradores explotaron la oxidación de Corey-Kim oxidando selectivamente el alcohol secundario menos obstaculizado (esquema 15).
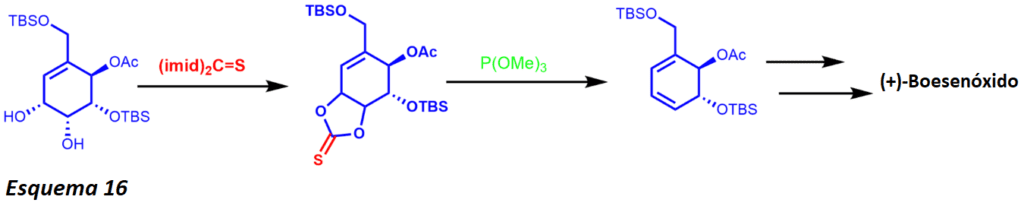
La olefinación de Corey-Winter es una transformación estereoespecífica de 1,2 dioles en alquenos que involucra al sustrato de diol, tiocarbonildiimidazol, y al exceso de trialquilfosfito. El mecanismo se ha reducido a dos vías posibles, pero se desconoce el mecanismo exacto. Específicamente, la reacción entre el tionocarbonato y el trialquilfosfito procede ya sea a través de la formación de una especie de fósforo ylido o de un intermedio de carbenoide. No obstante, la reacción es estereoespecífica para la mayoría de los sustratos, a menos que el producto dé lugar a una estructura excesivamente tensa.
La formación de transalcenos estéricamente obstaculizados presentes en los anillos de 7 miembros fue intentada por Corey y sus colaboradores, pero no tuvo éxito incluso cuando se empleó esta nueva metodología sintética que provocó una enorme tensión en los anillos. Lo que es más importante, los alquenos estereoespaciales están presentes en varios productos naturales, ya que el método sigue siendo explotado para producir una serie de sustratos complejos. El profesor T.K.M Shing y otros utilizaron la reacción de olefinación de Corey-Winter para sintetizar (+)-Boesenóxido (esquema 16).
La reacción CBS enantioselectiva Diels-Alder ha sido desarrollada usando un andamiaje similar al de la reducción enantioselectiva CBS. Después del desarrollo de esta reacción el reactivo CBS demostró ser un reactivo muy versátil para una serie de varias transformaciones sintéticas poderosas. El uso de un ácido de Lewis quiral como el catalizador CBS incluye un amplio rango de sustratos de enones insaturados. La reacción probablemente procede a través de un estado de pre-transición de anillo de 6 miembros altamente organizado para entregar productos altamente enriquecidos con enanos (esquema 17).

Este estado de transición se produce probablemente debido a un apilamiento pi favorable con el sustituto del fenilo. La enantioselectividad del proceso se ve facilitada por el acercamiento del dieno al dienófilo desde la cara opuesta del sustituto del fenilo. La reacción Diels-Alder es una de las transformaciones más poderosas de la química sintética. La síntesis de productos naturales utilizando la reacción Diels-Alder como transformación se ha aplicado especialmente a la formación de anillos de seis miembros (esquema 18).

La macrolactonización de Corey-Nicolaou proporciona el primer método para preparar lactonas de tamaño medio a grande. Anteriormente, la lactonización intermolecular superaba a la intramolecular incluso a bajas concentraciones. Una gran ventaja de esta reacción es que se realiza en condiciones neutras permitiendo la presencia de grupos funcionales ácidos y basales. Hasta la fecha se han sintetizado con éxito anillos de 7 a 48 miembros utilizando este método.
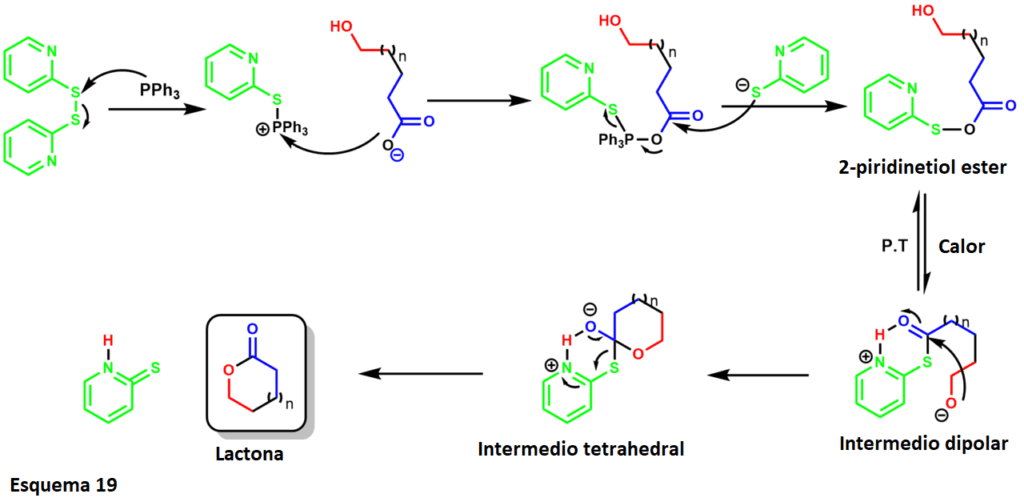
La reacción se produce en presencia del disulfuro de 2,2′-dipiridilo y la trifenilfosfina. La reacción generalmente se refluye en un disolvente no polar como el benceno. El mecanismo comienza con la formación del éster de 2-piridinethiol (esquema 19). La transferencia de protones proporciona un intermediario dipolar en el que el nucleófilo de alcóxido ataca el centro carbonilo electrofílico, proporcionando un intermediario tetraédrico que produce el producto de la macrolactona. Uno de los primeros ejemplos de este protocolo se aplicó a la síntesis total de la zearalenona (esquema 20).

La reacción de Johnson-Corey-Chaykovsky es útil para la síntesis de epóxidos y ciclopropanos. La reacción forma in situ un cloruro de azufre que reacciona con enones, cetonas, aldehídos e iminas para formar los correspondientes epóxidos, ciclopropanos y aziridinas.
Se han empleado dos variantes de iluro de azufre que dan diferentes productos quimioselectivos (esquema 21). El metileno dimetilsulfonio proporciona epóxidos a partir de las cetonas, pero produce los ciclopropanos cuando se emplean enones. El metileno de dimetilsulfonio transforma las cetonas y las enonas en los epóxidos correspondientes. El metilide de dimetilsulfonio es mucho más reactivo y menos estable que el metilide de dimetilsulfonio, por lo que se genera a bajas temperaturas
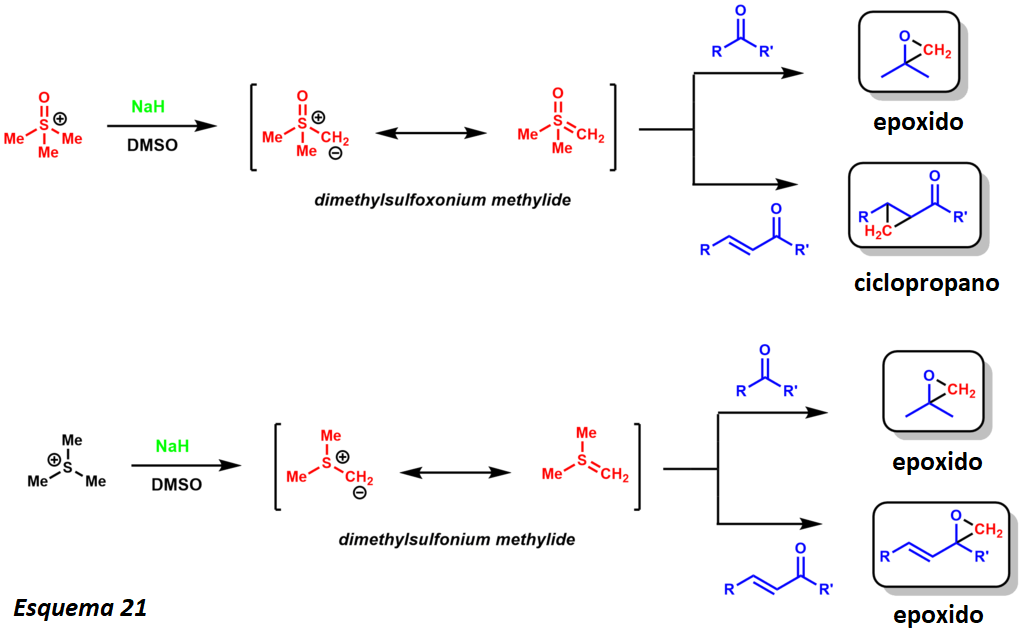
Basándose en su reactividad, otra ventaja distintiva de estas dos variantes es que cinéticamente proporcionan una diferencia en la diastereoselectividad. La reacción está muy bien establecida, y también se han logrado variantes enantioselectivas (catalíticas y estequiométricas). Desde el punto de vista del análisis retrosintético, esta reacción ofrece una alternativa razonable a las reacciones de epoxidación convencionales con alquenos (esquema 22). Danishefsky utilizó esta metodología para la síntesis del taxol. La diastereoselectividad se establece por medio de 1,3 interacciones en el estado de transición requerido para el cierre del epóxido.

Síntesis total
E. J. Corey y su grupo de investigación han completado muchas síntesis totales. Al menos 265 compuestos han sido sintetizados en el grupo Corey desde 1950.
Sus síntesis totales de 1969 de varias prostaglandinas se consideran clásicas. Específicamente la síntesis de la Prostaglandina F2α presenta varios desafíos. La presencia de olefinas cis y trans, así como de cinco átomos de carbono asimétricos hace que la molécula sea un desafío deseable para los químicos orgánicos. El análisis retrosintético de Corey esboza algunas desconexiones clave que conducen a la simplificación de los precursores (esquema 23).
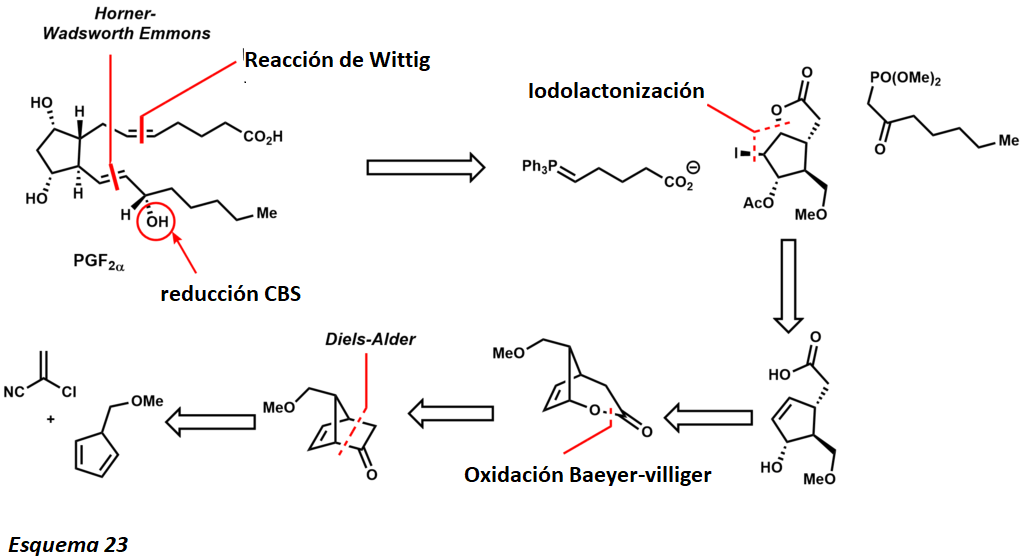
La simplificación molecular comenzó primero desconectando ambas cadenas de carbono con una reacción de Wittig y una modificación de la reacción de Horner-Wadsworth Emmons. La reacción Wittig proporciona el producto cis, mientras que la reacción Horner-Wadsworth Emmons producen la trans olefina. La síntesis publicada revela una mezcla diastereomérica 1:1 de la reducción de carbonilo utilizando borohidruro de zinc. Sin embargo, años más tarde Corey y sus colaboradores establecieron la reducción del CBS. Uno de los ejemplos que ejemplificaron este protocolo fue un intermedio en la síntesis de prostaglandinas que revela una mezcla 9:1 del diastereómero deseado (esquema 24)
La transformación de la yodolactonización permite un alcohol alílico que conduce a un intermedio clave de Baeyer-Villiger. Esta oxidación inserta regioselectivamente un átomo de oxígeno entre la cetona y el sitio más rico en electrones. El intermediario clave conduce a una conversión directa al objetivo estructural de Diels-Alder, que proporciona el marco de carbono para el anillo funcionalizado del ciclopentano. Más tarde Elias James Corey desarrolló una reacción asimétrica de Diels-Alder empleando una oxazoborolidina quiral, simplificando enormemente la ruta sintética hacia las prostaglandinas.
Publicaciones
Elias James Corey tiene más de 1100 publicaciones. En 2002, la Sociedad Americana de Química (ACS) lo reconoció como el «Autor más citado en química». En 2007, recibió el primer premio de la División de Publicaciones de la ACS «Cycle of Excellence High Impact Contributor Award» y fue clasificado como el químico número uno en términos de impacto de la investigación por el Índice Hirsch (índice h).

Polémicas en torno a Elias James Corey
Suicidio de Jason Altom
Jason Altom, uno de los estudiantes de Corey, se suicidó en 1998. El suicidio de Altom causó controversia porque culpó explícitamente a Corey, su asesor de investigación, de su suicidio. Altom citó en su nota de despedida de 1998 «supervisores de investigación abusivos» como una de las razones para quitarle la vida. La nota de suicidio de Altom también contenía instrucciones explícitas sobre cómo reformar la relación entre los estudiantes y sus supervisores.
Aunque Altom fue el segundo suicidio en otros tantos años en el laboratorio de Corey, Corey estaba devastado y desconcertado por la muerte de su estudiante, Corey dijo: «Esa carta no tiene sentido. Al final, Jason debe haber sido delirante o irracional en extremo» Corey también afirmó que nunca cuestionó las contribuciones intelectuales de Altom. «Hice mi mejor esfuerzo para guiar a Jason como un guía de montaña lo haría para guiar a alguien escalando una montaña. Hice lo mejor que pude en cada paso del camino«, afirma Corey. «Mi conciencia está limpia. Todo lo que Jason hizo salió de nuestra sociedad. Nunca tuvimos el más mínimo desacuerdo«.
La Fundación Americana para la Prevención del Suicidio (AFSP) citó el artículo del New York Times sobre el suicidio de Altom como un ejemplo de reportaje problemático, argumentando que Altom presentaba señales de advertencia de depresión e ideación suicida y que el artículo había convertido a Corey en chivo expiatorio a pesar de la falta de pruebas secundarias de que el comportamiento del asesor hubiera contribuido a la angustia de Altom. Según el reportaje del Boston Globe, los estudiantes y profesores dijeron que Altom tenía el apoyo de Corey.
Como resultado de la muerte de Altom, el Departamento de Química aceptó una propuesta que permitía a los estudiantes de postgrado pedir a dos miembros adicionales de la facultad que desempeñaran un pequeño papel de asesoramiento en la preparación de una tesis.
Las reglas Woodward-Hoffmann
Cuando se le concedió la Medalla Priestley en 2004, E. J. Corey creó una controversia con su afirmación de haber inspirado a Robert Burns Woodward antes del desarrollo de las reglas Woodward-Hoffmann. Corey escribió:
«El 4 de mayo de 1964, sugerí a mi colega R. B. Woodward una explicación simple que involucraba la simetría de las órbitas moleculares perturbadas (HOMO) para las conversiones de ciclohexadieno estereoselectivo → 1,3-butadieno y 1,3,5-hexatrieno → que proporcionaron la base para el desarrollo posterior de estas ideas en lo que se conoció como las reglas de Woodward-Hoffmann«.
Esta fue la primera declaración pública de Corey sobre su afirmación de que a partir del 5 de mayo de 1964 Woodward presentó la explicación de Corey como su propio pensamiento sin mencionar a Corey y la conversación del 4 de mayo. Corey había discutido su afirmación en privado con Hoffmann y colegas cercanos desde 1964. Corey menciona que hizo la declaración de Priestley «para que el registro histórico sea correcto».
La afirmación y la contribución de Elias James Corey fueron refutadas públicamente por Roald Hoffmann en la revista Angewandte Chemie. En la refutación, Hoffmann afirma que le preguntó a Corey en el curso de su larga discusión sobre el asunto por qué Corey no hizo público el asunto. Corey respondió que pensaba que tal desacuerdo público perjudicaría a Harvard y que no «consideraría hacer nada en contra de Harvard, a la que yo era y soy tan devoto». Corey también esperaba que el propio Woodward corrigiera el registro histórico «a medida que envejecía, era más considerado y sensible a su propia conciencia» Woodward murió repentinamente de un ataque al corazón mientras dormía en 1979.
Premios y honores de Elias James Corey
E. J. Corey ha recibido más de 40 premios importantes, entre ellos el Premio Linus Pauling (1973), la Medalla Franklin (1978), el Premio Tetrahedron (1983), el Premio Wolf de Química (1986), la Medalla Nacional de Ciencia (1988), el Premio Japón (1989), el Premio Nobel de Química (1990), el Premio Placa de Oro de la American Academy of Achievement (1991), el Premio Roger Adams (1993) y la Medalla Priestley (2004). Fue incluido en el Salón de la Fama de Alpha Chi Sigma en 1998. A partir de 2008, ha recibido 19 títulos honoríficos de universidades de todo el mundo, entre ellas la Universidad de Oxford (Reino Unido), la Universidad de Cambridge (Reino Unido) y la Universidad Nacional de Chung Cheng. En 2013, se inauguró el Instituto de Investigación Biomédica E.J. Corey (CIBR) en Jiangyin, provincia de Jiangsu, China.
Elias James Corey fue elegido Miembro Extranjero de la Sociedad Real (ForMemRS) en 1998.
Para más información Elias James Corey – Biographical – NobelPrize.org
Como citar este artículo:
APA: (2021-07-12). Elias James Corey. Recuperado de https://quimicafacil.net/infografias/biografias/elias-james-corey/
ACS: . Elias James Corey. https://quimicafacil.net/infografias/biografias/elias-james-corey/. Fecha de consulta 2026-03-03.
IEEE: , "Elias James Corey," https://quimicafacil.net/infografias/biografias/elias-james-corey/, fecha de consulta 2026-03-03.
Vancouver: . Elias James Corey. [Internet]. 2021-07-12 [citado 2026-03-03]. Disponible en: https://quimicafacil.net/infografias/biografias/elias-james-corey/.
MLA: . "Elias James Corey." https://quimicafacil.net/infografias/biografias/elias-james-corey/. 2021-07-12. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net