Actualizado en enero 10, 2024
Tiempo de lectura estimado: 8 minutos
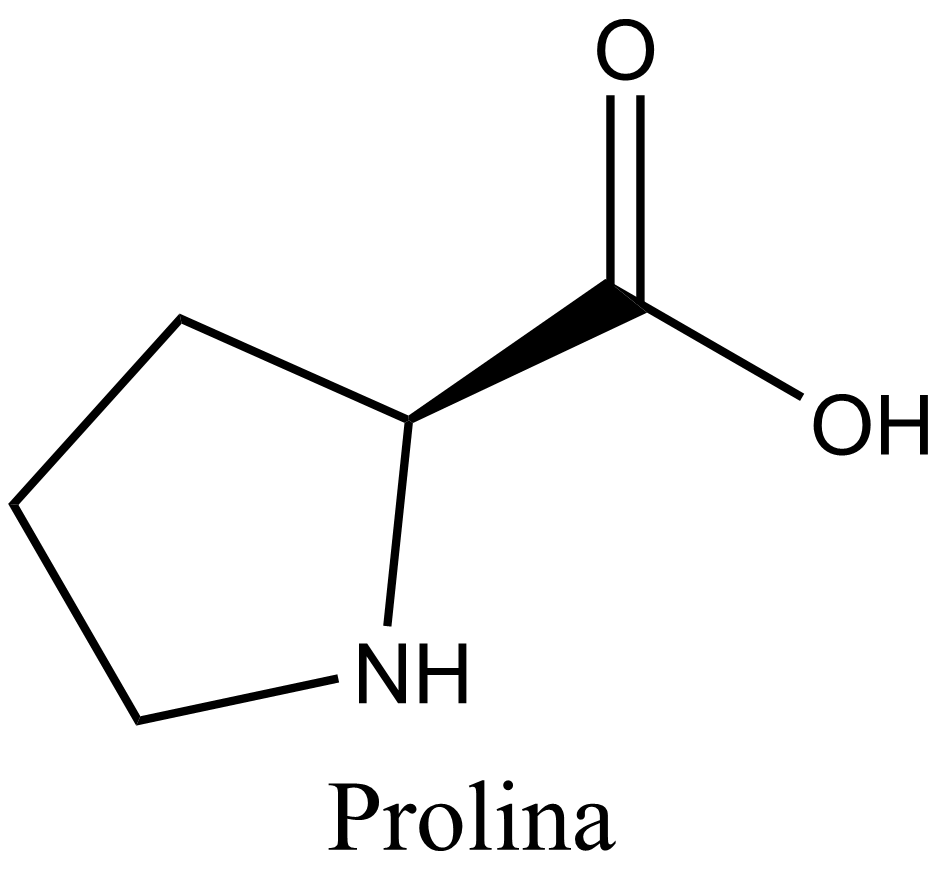
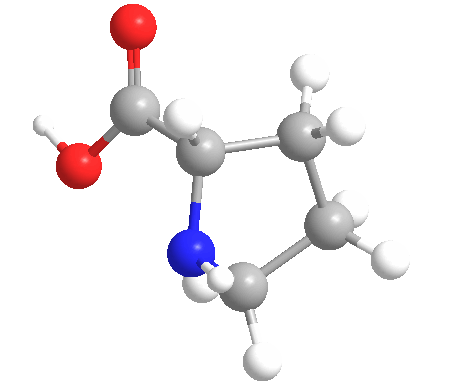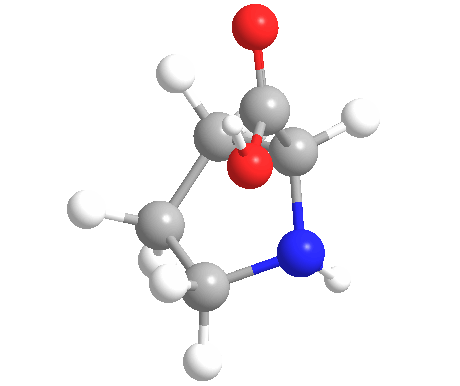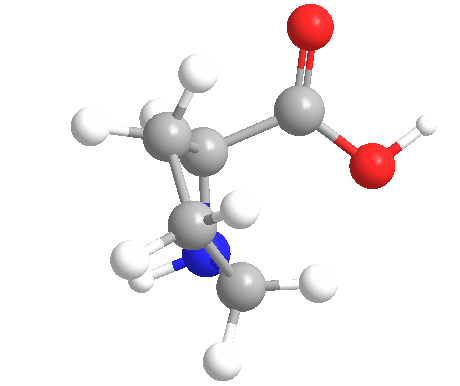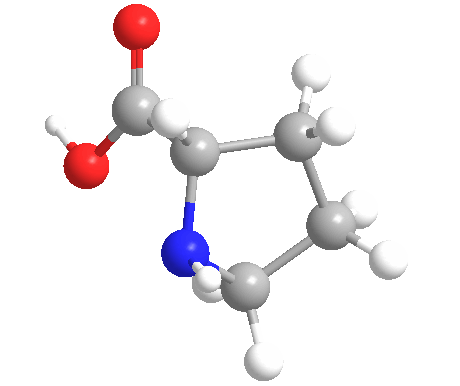
La prolina (símbolo Pro o P) es un ácido orgánico clasificado como un aminoácido proteinogénico (utilizado en la biosíntesis de las proteínas), aunque no contiene el grupo amino -NH2 pero es más bien una amina secundaria. El nitrógeno de la amina secundaria está en la forma protonada NH2+ en condiciones biológicas, mientras que el grupo carboxilo está en la forma desprotonada -COO-. La «cadena lateral» del carbono α se conecta al nitrógeno formando un bucle de pirrolidina, clasificándolo como un aminoácido alifático. No es esencial en los humanos, lo que significa que el cuerpo puede sintetizarlo a partir del aminoácido no esencial L-glutamato. Está codificado por todos los codones empezando por CC (CCU, CCC, CCA y CCG).
La prolina es el único aminoácido proteinogénico que es una amina secundaria, ya que el átomo de nitrógeno está unido al carbono α por una cadena de otros tres átomos de carbono.
Historia de la prolina
La prolina fue aislada por primera vez en 1900 por Richard Willstätter que obtuvo el aminoácido mientras estudiaba la N-metilprolina. El año después de que Emil Fischer publicara la síntesis de prolina a partir del éster propilmalónico de ftalimida. El nombre de prolina proviene de la pirrolidina, uno de sus componentes.
Química
La prolina se deriva biosintéticamente del aminoácido L-glutamato. El glutamato-5-semialdehído se forma primero por la glutamato 5-quinasa (dependiente del ATP) y la glutamato-5-semialdehído deshidrogenasa (que requiere NADH o NADPH). Luego puede ciclarse espontáneamente para formar ácido 1-pirrolina-5-carboxílico, que se reduce a prolina por la pirrolina-5-carboxilato reductasa (utilizando NADH o NADPH), o se convierte en ornitina por la ornitina aminotransferasa, seguida de la ciclización por la ornitina ciclodeaminasa para formar prolina.
Se ha descubierto que la L-Prolina actúa como un agonista débil del receptor de la glicina y de los receptores de glutamato ionotrópico tanto del NMDA como de los que no lo son (AMPA/kainato). Se ha propuesto que es una excitotoxina endógena potencial. En las plantas, la acumulación de prolina es una respuesta fisiológica común a diversas tensiones, pero también forma parte del programa de desarrollo en los tejidos generativos (por ejemplo, el polen).
Rol de la prolina en la estructura de proteínas
La estructura cíclica distintiva de la cadena lateral de la prolina le da a la prolina una rigidez conformacional excepcional en comparación con otros aminoácidos. También afecta a la tasa de formación de enlaces peptídicos entre la prolina y otros aminoácidos. Cuando la prolina se une como una amida en un enlace peptídico, su nitrógeno no se une a ningún hidrógeno, lo que significa que no puede actuar como un donante de enlace de hidrógeno, pero puede ser un aceptador de enlace de hidrógeno.
La formación de enlaces peptídicos con el Pro-tRNAPro entrante es considerablemente más lenta que con cualquier otro tRNA, lo cual es una característica general de los N-alquilaminoácidos. La formación de enlaces peptídicos también es lenta entre un tRNA entrante y una cadena que termina en prolina; siendo la creación de enlaces de prolina-prolina la más lenta de todas.
La excepcional rigidez conformacional de la prolina afecta a la estructura secundaria de las proteínas cercanas a un residuo de prolina y puede explicar la mayor prevalencia de la prolina en las proteínas de los organismos termófilos. La estructura secundaria de la proteína puede describirse en términos de los ángulos diedros φ, ψ y ω de la espina dorsal de la proteína. La estructura cíclica de la cadena lateral de la prolina bloquea el ángulo φ a aproximadamente -65°.
La prolina actúa como un disruptor estructural en medio de elementos de estructura secundaria regular como las hélices alfa y las hojas beta; sin embargo, la prolina se encuentra comúnmente como el primer residuo de una hélice alfa y también en los filamentos de los bordes de las hojas beta. La prolina también se encuentra comúnmente en las espiras (otro tipo de estructura secundaria), y ayuda a la formación de espiras beta. Esto puede explicar el curioso hecho de que la prolina suele estar expuesta a disolventes, a pesar de tener una cadena lateral completamente alifática.
Múltiples prolinas y/o hidroxiprolinas en una fila pueden crear una hélice de poliprolina, la estructura secundaria predominante en el colágeno. La hidroxilación de la prolina por la prolil hidroxilasa (u otras adiciones de sustitutos que retienen electrones, como el flúor) aumenta considerablemente la estabilidad conformacional del colágeno.
Por lo tanto, la hidroxilación de la prolina es un proceso bioquímico crítico para el mantenimiento del tejido conectivo de los organismos superiores. Enfermedades graves como el escorbuto pueden ser el resultado de defectos en esta hidroxilación, por ejemplo, mutaciones en la enzima prolil hidroxilasa o la falta del necesario cofactor ascorbato (vitamina C).
Isomería
Los enlaces peptídicos a la prolina y a otros aminoácidos sustituidos por N (como la sarcosina), son capaces de poblar tanto los isómeros cis como los trans. La mayoría de los enlaces peptídicos adoptan de manera abrumadora el isómero trans (típicamente el 99,9% en condiciones no forzadas), principalmente porque el hidrógeno amida (isómero trans) ofrece menos repulsión estérica al átomo Cα precedente que el átomo Cα siguiente (isómero cis).
Por el contrario, los isómeros cis y trans del enlace peptídico X-Pro (donde X representa cualquier aminoácido) experimentan ambos choques estéricos con la sustitución vecina y tienen una diferencia de energía mucho menor. Por lo tanto, la fracción de enlaces peptídicos X-Pro en el isómero cis en condiciones no forzadas es significativamente elevada, con fracciones cis típicamente en el rango de 3-10%. Sin embargo, estos valores dependen del aminoácido precedente, con residuos de Gly y aromáticos que producen mayores fracciones del isómero cis.
Desde el punto de vista cinético, la isomerización de la prolina cis-trans es un proceso muy lento que puede impedir el progreso del plegamiento de la proteína atrapando uno o más residuos de prolina cruciales para el plegamiento en el isómero no nativo, especialmente cuando la proteína nativa requiere el isómero cis. Esto se debe a que los residuos de prolina se sintetizan exclusivamente en el ribosoma como la forma del isómero trans.
Todos los organismos poseen enzimas de isomerasa de prolilo para catalizar esta isomerización, y algunas bacterias tienen isomerasas de prolilo especializadas asociadas con el ribosoma. Sin embargo, no todas las prolinas son esenciales para el plegamiento, y el plegamiento de las proteínas puede proceder a un ritmo normal a pesar de tener conformadores no nativos de muchos enlaces peptídicos X-Pro.
Usos de la prolina
La prolina y sus derivados se utilizan a menudo como catalizadores asimétricos en las reacciones de organocatálisis de la prolina. La reducción del CBS y la condensación de aldol catalizada por la prolina son ejemplos destacados.
En la elaboración de cerveza, las proteínas ricas en prolina se combinan con polifenoles para producir neblina (turbidez).
La L-Prolina es un osmoprotector y, por lo tanto, se utiliza en muchas aplicaciones farmacéuticas y biotecnológicas.
El medio de crecimiento utilizado en el cultivo de tejidos vegetales puede complementarse con la prolina. Esto puede aumentar el crecimiento, tal vez porque ayuda a la planta a tolerar el estrés del cultivo de tejidos.
Curiosidades
La prolina es uno de los dos aminoácidos que no siguen la típica grafica de Ramachandran, junto con la glicina. Debido a la formación de anillos conectados al carbono beta, los ángulos ψ y φ sobre el enlace peptídico tienen menos grados de rotación permitidos. Como resultado, a menudo se encuentra en «giros» de las proteínas, ya que su entropía libre (ΔS) no es tan grande en comparación con otros aminoácidos y, por lo tanto, en una forma plegada frente a la forma desplegada, el cambio de entropía es menor. Además, la prolina rara vez se encuentra en las estructuras de α y β, ya que reduciría la estabilidad de esas estructuras, porque su cadena lateral α-N sólo puede formar un enlace de nitrógeno.
Además, la prolina es el único aminoácido que no forma un color rojo/púrpura cuando se revela mediante la pulverización de ninhidrina para su uso en cromatografía. La prolina, en cambio, produce un color naranja/amarillo.
Para más información Proline
Como citar este artículo:
APA: (2021-04-27). Prolina. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/prolina/
ACS: . Prolina. https://quimicafacil.net/compuesto-de-la-semana/prolina/. Fecha de consulta 2024-07-27.
IEEE: , "Prolina," https://quimicafacil.net/compuesto-de-la-semana/prolina/, fecha de consulta 2024-07-27.
Vancouver: . Prolina. [Internet]. 2021-04-27 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/prolina/.
MLA: . "Prolina." https://quimicafacil.net/compuesto-de-la-semana/prolina/. 2021-04-27. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net