Tiempo de lectura estimado: 13 minutos
La cromatografía en capa delgada (TLC) es una técnica cromatográfica utilizada para separar mezclas no volátiles. La cromatografía en capa fina se realiza en una hoja de vidrio, plástico o papel de aluminio, que se recubre con una fina capa de material adsorbente, generalmente gel de sílice, óxido de aluminio (alúmina) o celulosa. Esta capa de adsorbente se conoce como la fase estacionaria.
Índice de retención
Los diferentes compuestos de la mezcla de la muestra viajan a velocidades diferentes debido a las diferencias en su atracción por la fase estacionaria y a las diferencias en la solubilidad del disolvente. Cambiando el disolvente, o tal vez utilizando una mezcla, se puede ajustar la separación de los componentes (medida por el valor Rf).
Una forma conveniente para informar los resultados de una placa de TLC es a través de un «factor de retención», o valor Rf, que cuantifica el movimiento de un compuesto

Para medir la distancia recorrida por un compuesto, se mide la distancia desde la ubicación original del compuesto (la línea de base marcada con lápiz) hasta la ubicación del compuesto después de la elución (el centro aproximado del punto, Figura 1a). Debido a la naturaleza aproximada de esta medición, los valores de la regla deben registrarse sólo al milímetro más cercano. Para medir la distancia recorrida por el disolvente, se mide la distancia desde la línea de base hasta el frente del disolvente.

El frente de disolvente (Figura 1b) es esencial para este Rf cálculo. Cuando se retira una placa de TLC de su cámara, el frente del disolvente debe ser marcado inmediatamente con un lápiz, ya que el disolvente a menudo se evapora rápidamente.
El Rf es una relación, y representa la distancia relativa que el punto viajó en comparación con la distancia que podría haber recorrido si se moviera con el frente del disolvente. Un Rf de 0,55 significa que el punto se movió un 55% hasta el frente del disolvente, o un poco más de la mitad.
Como un Rf es esencialmente un porcentaje, no es particularmente importante dejar que una TLC corra a una altura determinada en la placa de cromatografia. En la figura 2, una muestra de acetofenona se eluyó a diferentes alturas, y se calculó que el Rf en cada caso era similar, aunque no idéntico. Las ligeras variaciones en el Rf surgen del error asociado a las mediciones de la regla, pero también de las diferentes cantidades de agua adsorbida en las placas de TLC que alteran las propiedades del adsorbente. Los valores de Rf deben considerarse siempre como aproximados.

Aunque en teoría una TLC puede correr a cualquier altura, es costumbre dejar que el disolvente corra aproximadamente a 0,5 cm de la parte superior de la placa para minimizar el error en los cálculos de índice de retención, y para lograr la mejor separación de las mezclas. No se debe permitir que una placa de cromatografía se corra completamente hasta la parte superior de la placa ya que puede afectar a los resultados. Sin embargo, si se utiliza una cámara de TLC saturada y sellada, la Rf todavía puede ser calculada.
Teoría de separación
En todas las formas de cromatografía, las muestras se equilibran entre las fases estacionaria y móvil. En casi todas las aplicaciones de la cromatografía en capa fina, la fase estacionaria es un adsorbente de sílice o alúmina y la fase móvil es un solvente orgánico o una mezcla de solventes (el «eluyente») que sube por la placa.

El gel de sílice (que se muestra en la figura 3) está compuesto por una red de enlaces de silicio-oxígeno, con enlaces O-H en su superficie, así como una capa de moléculas de agua. El gel de sílice (SiO2⋅xH2O) se utiliza en esta discusión, pero es estructuralmente análogo a la alúmina (Al2O3⋅xH2O).
Esta fase estacionaria muy polar está emparejada con una fase móvil relativamente no polar (un disolvente o solución orgánica), en lo que se denomina TLC de «fase normal». Aunque ésta es la forma más común de cromatografía en capa delgada (y en la que se centrará este articulo), a veces se utiliza la TLC de «fase inversa» (con una fase estacionaria no polar y una fase móvil polar).
En la figura 3 se muestra cómo la acetofenona se adhiere a la superficie del gel de sílice mediante fuerzas intermoleculares (IMF). En este caso, la acetofenona puede adherirse con hidrógeno (el IMF indicado en la figura 3a) a la superficie de sílice a través de su átomo de oxígeno. A medida que el eluyente fluye sobre la muestra (Figura 3b), se establece un equilibrio entre la muestra que se adsorbe en la fase estacionaria y se disuelve en la fase móvil. Cuando está en la fase móvil, el compuesto se mueve hacia arriba de la placa con el flujo de líquido (Figura 3c) para luego ser absorbido en la fase estacionaria más arriba de la placa. El Rf resultante del compuesto depende de la cantidad de tiempo que se pase en las fases estacionaria y móvil.

La distribución del equilibrio entre las dos fases depende de varios factores:
- Depende de la fuerza de las fuerzas intermoleculares entre la muestra y la fase estacionaria.
Un compuesto que forma fuertes IMFs con la sílice o la alúmina a menudo favorecerá la fase estacionaria, y pasará gran parte del tiempo de elución adherido a la placa. Esto significa que pasará menos tiempo en la fase móvil (que es el único medio para que suba por la placa), lo que hará que termine bajo la placa TLC, y que tenga un bajo Rf.
Los compuestos que tienen átomos de oxígeno o nitrógeno deberían ser capaces de unirse al hidrógeno con la fase estacionaria (tienen IMFs fuertes con la fase estacionaria), y por lo tanto tendrán valores de Rf más bajos que los compuestos de tamaño similar que sólo pueden interactuar a través de las fuerzas de dispersión de London (LDFs).
- Depende de la fuerza de la interacción entre la muestra y la fase móvil.
Como la fase móvil siempre es menos polar que la fase estacionaria en la cromatografía en capa delgada de fase normal, los compuestos polares tenderán a tener una menor afinidad con la fase móvil que los compuestos no polares (según el principio de «lo que es igual se disuelve igual»). Por lo tanto, los compuestos polares tienden a pasar menos tiempo de elución móvil que un compuesto no polar, por lo que viajarán «más lentamente» por la placa, y tendrán un bajo Rf.
El grado de atracción de un compuesto por las fases estacionaria y móvil llevan a la misma conclusión:
- Cuanto más fuerte sea las fuerzas intermoleculares con la fase estacionaria (a menudo los grupos funcionales más polares en un compuesto), más tiempo estará el compuesto estacionario → Baja el Rf
- Cuantos más grupos funcionales polares estén presentes en un compuesto, menos tiende a ser atraído por el eluyente menos polar, y menos tiempo estará el compuesto en movimiento → Baja el Rf.
Así, un compuesto con un Rf más bajo tiende a tener más grupos funcionales polares que un compuesto con un Rf más alto
Consideraciones estructurales
Para demostrar el efecto de las características estructurales en el Rf en la figura 4 se muestra una placa de TLC eluida de alcohol bencílico, benzaldehído y etilbenceno. El orden relativo de Rf refleja la tendencia de la polaridad en la serie.

El alcohol bencílico y el benzaldehído tienen grupos funcionales polares, por lo que tienen valores de Rf más bajos que el etilbenceno, que es completamente no polar. Ambos compuestos son capaces de que el hidrógeno se una a la fase estacionaria polar (Figura 5a+b), por lo que son más fuertemente atraídos a la fase estacionaria que el etilbenceno, que interactúa sólo a través de las débiles fuerzas de dispersión de London (Figura 5c). Al ser el menos «polar» de la serie, el etilbenceno es también el mejor disuelto por el eluyente débilmente polar. Por estas razones, el etilbenceno pasó el menor tiempo en la fase estacionaria y el mayor tiempo en la fase móvil, razón por la cual viajó el mayor tiempo hacia arriba de la placa y tuvo la mayor Rf de la serie.
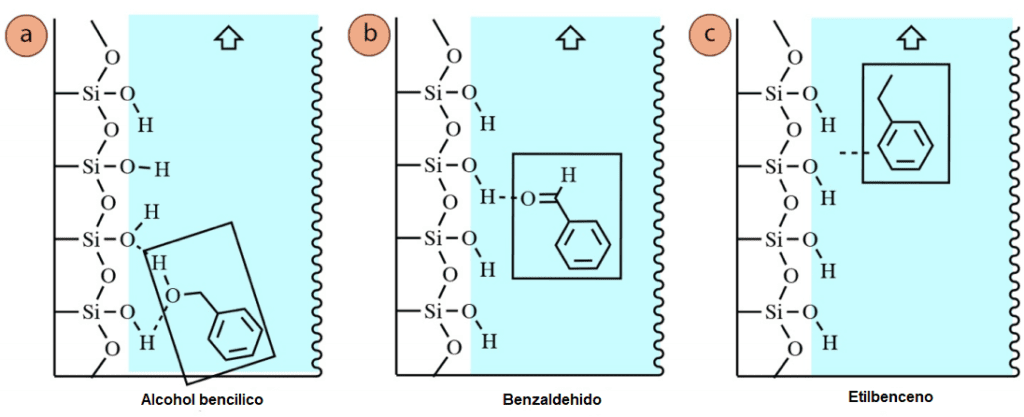
Figura 5: Fuerzas intermoleculares entre el gel de sílice y: a) el alcohol bencílico, b) el benzaldehído, c) el etilbenceno.
Tanto el benzaldehído como el alcohol bencílico son capaces de enlazar el hidrógeno con la fase estacionaria, pero el alcohol bencílico tenía el menor Rf porque puede formar más enlaces de hidrógeno (a través de los átomos de oxígeno e hidrógeno del OH grupo, figura 5a). Esto hizo que el alcohol bencílico se adhiriera más fuertemente a la sílice/alúmina que el benzaldehído, lo que hizo que pasara más tiempo en la fase estacionaria.
Para demostrar un efecto estructural diferente sobre el Rf una placa de TLC eluida de acetofenona y benzofenona se muestra en la figura 6. Ambos compuestos son similares en el sentido de que pueden unir el hidrógeno a la fase estacionaria a través de su átomo de oxígeno. Sin embargo, el mayor tamaño de la benzofenona hace que tenga un Rf ligeramente más alto que la acetofenona.
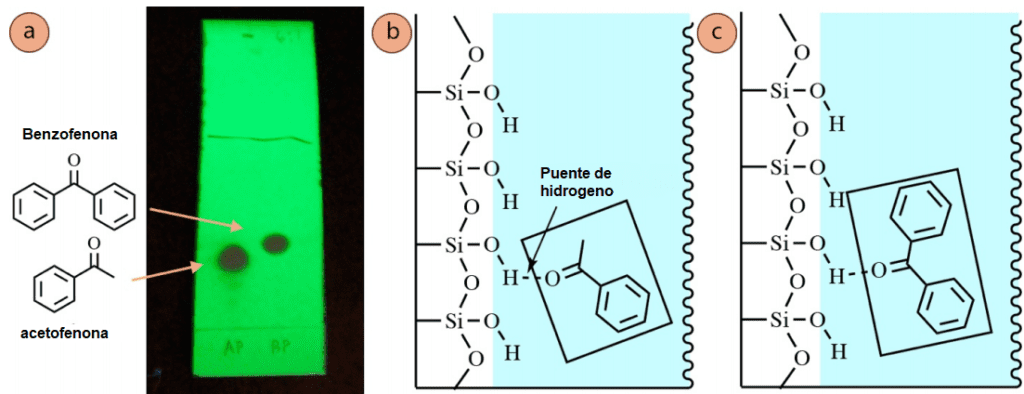
Este resultado puede explicarse de múltiples maneras:
- El átomo de oxígeno de la benzofenona está más atestado por los anillos aromáticos que el átomo de oxígeno de la acetofenona, lo que puede impedir su capacidad de unirse fuertemente al hidrógeno con el gel de sílice. Esto puede llevar a una menor cantidad de tiempo absorbido por la fase estacionaria.
- El volumen no polar adicional de la benzofenona hace que se disuelva mejor en el eluyente débilmente polar, lo que hace que pase más tiempo en la fase móvil.
Polaridad de la fase móvil
La capacidad de la cromatografía para separar los componentes de una mezcla depende del equilibrio de un compuesto entre las fases estacionaria y móvil. Dado que la fase móvil es un factor importante, es posible cambiar el Rf de un compuesto cambiando la polaridad de la fase móvil.
Cuando una fase móvil se hace más polar que la original, todos los compuestos viajan más lejos y tienen un Rf más alto.
Esta tendencia general se demuestra en la Figura 7b+c, donde la cromatografía líquida de tres compuestos activos UV (carriles 2-4) se realizó utilizando dos disolventes mezclados diferentes. La primera plancha se ejecutó utilizando una mezcla de hexano: acetato de etilo de 6:1, lo que significa que el disolvente se creó utilizando 6 volúmenes de hexano por cada volumen de acetato de etilo.
Este disolvente mezclado es en su mayor parte no polar debido al alto porcentaje de hexano, pero es más polar que el hexano puro, debido a la presencia de algo de acetato de etilo (que tiene enlaces polares, figura 7a). La segunda placa se ejecutó utilizando una mezcla de hexano: acetato de etilo de 3:2, que es más polar que la mezcla de 6:1 porque hay un mayor porcentaje de acetato de etilo presente.

Un aumento de la polaridad de los disolventes aumenta el índice de retención por dos razones:
- Los compuestos moderadamente polares tienen una mayor atracción por la fase móvil.
Cuando se equilibra entre una fase estacionaria polar y un eluyente no polar, un compuesto polar tiende a favorecer la fase estacionaria polar y a tener un bajo Rf
Si se hace que el eluyente sea moderadamente polar, los compuestos polares se ven entonces más atraídos por la fase móvil, haciendo que el equilibrio cambie de tal manera que el compuesto pase más tiempo en la fase móvil, dando como resultado un mayor Rf
- El disolvente polar puede ocupar sitios de unión en la superficie de sílice o alúmina, de tal manera que desplazan la muestra de la fase estacionaria.
Si un disolvente polar es capaz de unirse al hidrógeno y, por lo tanto, está fuertemente asociado con la fase estacionaria, puede «bloquear» los sitios de unión y obligar a que menos compuestos polares pasen más tiempo en la fase móvil. El resultado es un aumento del índice de retención para compuestos polares y no polares por igual.
Para más información 2.2C: The Retention Factor
Como citar este artículo:
APA: (2020-09-09). Teoría detrás de la cromatografía en capa delgada (TLC). Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/teoria-detras-de-la-cromatografia-en-capa-delgada-tlc/
ACS: . Teoría detrás de la cromatografía en capa delgada (TLC). https://quimicafacil.net/tecnicas-de-laboratorio/teoria-detras-de-la-cromatografia-en-capa-delgada-tlc/. Fecha de consulta 2025-07-06.
IEEE: , "Teoría detrás de la cromatografía en capa delgada (TLC)," https://quimicafacil.net/tecnicas-de-laboratorio/teoria-detras-de-la-cromatografia-en-capa-delgada-tlc/, fecha de consulta 2025-07-06.
Vancouver: . Teoría detrás de la cromatografía en capa delgada (TLC). [Internet]. 2020-09-09 [citado 2025-07-06]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/teoria-detras-de-la-cromatografia-en-capa-delgada-tlc/.
MLA: . "Teoría detrás de la cromatografía en capa delgada (TLC)." https://quimicafacil.net/tecnicas-de-laboratorio/teoria-detras-de-la-cromatografia-en-capa-delgada-tlc/. 2020-09-09. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net