Actualizado en abril 25, 2022
Tiempo de lectura estimado: 11 minutos
El proceso de cristalización consta de dos acontecimientos principales, la nucleación y el crecimiento de los cristales, que se rigen por propiedades termodinámicas y químicas. En la cristalización, la nucleación es el paso en el que las moléculas o átomos de soluto dispersos en el disolvente comienzan a reunirse en racimos, a escala microscópica (elevando la concentración de soluto en una pequeña región), que se hacen estables en las condiciones de funcionamiento actuales. Estos cúmulos estables constituyen los núcleos.
Por lo tanto, los cúmulos deben alcanzar un tamaño crítico para convertirse en núcleos estables. Dicho tamaño crítico viene dictado por muchos factores diferentes (temperatura, sobresaturación, etc.). En la fase de nucleación, los átomos o las moléculas se organizan de forma definida y periódica, lo que define la estructura del cristal. Obsérvese que «estructura del cristal» es un término especial que se refiere a la disposición relativa de los átomos o las moléculas, no a las propiedades macroscópicas del cristal (tamaño y forma), aunque éstas sean resultado de la estructura interna del cristal.
Cristalización como técnica de purificación
La cristalización es una excelente técnica de purificación de sólidos porque un cristal que se forma lentamente a partir de una solución saturada tiende a incorporar selectivamente partículas del mismo tipo en su estructura cristalina (en la figura 1a se muestra un modelo de red cristalina). Un cristal puro suele tener una energía ligeramente inferior a la de un cristal impuro (o tiene una energía de red mayor), ya que el empaquetamiento de partículas idénticas en una red permite maximizar las fuerzas intermoleculares.

Si una impureza es más pequeña que la mayoría de las partículas de una red cristalina puede haber un «espacio muerto» alrededor de la impureza, lo que da lugar a una región con fuerzas intermoleculares no realizadas. Si la impureza es más grande que las demás partículas, puede alterar las fuerzas intermoleculares forzando a otras partículas de la red a desalinearse.
Un sólido en desarrollo tenderá a incorporar partículas del mismo tipo para crear el sólido de menor energía, y excluirá las impurezas que perturben el empaquetamiento idealizado del sólido. Este proceso funciona mejor si la impureza está presente como un componente menor del sólido en bruto. Cuando hay cantidades mayores de impurezas, el cristal resultante tiende a ser heterogéneo, con regiones puras de compuesto y regiones puras de «impureza» entremezcladas con regiones impuras. Este tipo de heterogeneidad se observa a menudo en la cristalización de minerales (Figura 1b).
Enfriamiento lento
La diferencia en la energía de la red cristalina entre los sólidos puros e impuros es marginal, por lo que una solución debe enfriarse LENTAMENTE para permitir la diferenciación. Si una solución caliente se sumerge inmediatamente en un baño de hielo, el sistema favorecerá la formación de un sólido (¡cualquier sólido!) con tanta fuerza que puede haber poca preferencia por la pureza. Las impurezas pueden quedar engullidas en el sólido en desarrollo y atrapadas a medida que los solutos se depositan de forma no selectiva en el sólido en crecimiento. Sólo cuando se deja el tiempo suficiente para el equilibrio entre el sólido en desarrollo y la solución, se forma el sólido puro de menor energía.

Como metáfora del lento proceso de cristalización, imagine que ha ganado un premio y se le permite entrar en un tubo, donde el dinero en forma de billetes de 1 y 100 dólares será soplado para que lo coja. Las reglas del premio establecen que sólo puedes quedarte con un total de veinte billetes. Imagina que te dan sólo 30 segundos en el tubo de dinero para coger veinte billetes: probablemente cogerás cualquier billete que tengas a mano, y esperas que la mayoría de ellos sean de 100 dólares. Si, en cambio, se le diera más tiempo en el tubo de dinero (quizás 10 minutos), podría ser menos frenético y más selectivo a la hora de elegir billetes de 100 dólares y excluir los de 1 dólar.
De forma similar, el proceso de cristalización puede considerarse como la red cristalina que «agarra» los solutos de la solución. Si el proceso se precipita, los solutos pueden ser «agarrados» indiscriminadamente, y una vez incrustados en el interior del sólido quedan atrapados, ya que el equilibrio entre el sólido y la solución sólo se produce en la superficie.
Además de una mayor pureza, un proceso de cristalización lento también favorece el crecimiento de cristales más grandes. La figura 2 muestra la cristalización de la acetanilida a partir del agua con dos velocidades diferentes. Los cristales crecidos en la Figura 2a se formaron mucho más rápidamente y son más pequeños que los cristales más grandes y de crecimiento más lento de la Figura 2b.
Los cristales más grandes tienen varias ventajas. La más importante es que tienden a ser más puros que los cristales pequeños. También tienen una menor superficie expuesta al líquido madre, lo que hace que el lavado de los cristales sea más eficaz. Por último, son más fáciles de recoger mediante filtración por succión (figura 3), ya que los cristales muy pequeños pueden atravesar o encajarse en los poros del papel de filtro, impidiendo que el disolvente pase fácilmente y dando lugar a cristales irrecuperables.
Utilizar la mínima cantidad de disolvente caliente
La cantidad de disolvente utilizada en la cristalización suele ser mínima, para favorecer el objetivo de recuperar la máxima cantidad de cristales.
Todo sólido tiene una solubilidad parcial en los disolventes utilizados, incluso a temperaturas frías. En la figura 4, el disolvente frío que rodea a un sólido amarillo se tiñe de amarillo al disolverse algún compuesto. Los sólidos que parecen insolubles en un disolvente tienen de hecho una porción (normalmente pequeña) de material que se disuelve. Esto es análogo a cómo los compuestos iónicos «insolubles en agua» (como el AgCl tienen una constante de producto de solubilidad no nula (Ksp).
La cristalización es más común con los sólidos que tienen una solubilidad moderada a bajas temperaturas, por lo que el calor puede «inclinarlos hacia el borde» para que se disuelvan completamente. Esto significa que, en la práctica, habrá una cantidad de compuesto que se disuelve en el licor madre a bajas temperaturas, que puede ser significativa dependiendo del perfil de solubilidad del compuesto. El uso de la cantidad mínima de disolvente caliente disminuye la cantidad de compuesto que se pierde en el licor madre.
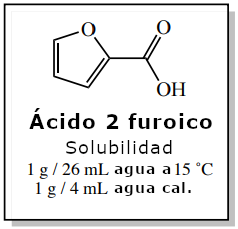
Para demostrar la importancia de utilizar la mínima cantidad de disolvente caliente durante una cristalización, imagine que va a cristalizar 5,0 g de ácido 2-furoico utilizando agua caliente. Los cálculos de este ejemplo se describen a continuación y se resumen en la figura 6.
El ácido 2-furoico tiene una mayor solubilidad en agua hirviendo que en agua fría, como muestran los datos de solubilidad de la Figura 5. La cantidad de disolvente caliente necesaria para disolver esta muestra puede calcularse utilizando la solubilidad del compuesto en agua caliente, como se muestra a continuación. Esto representa la «cantidad mínima de disolvente caliente» necesaria para la cristalización.
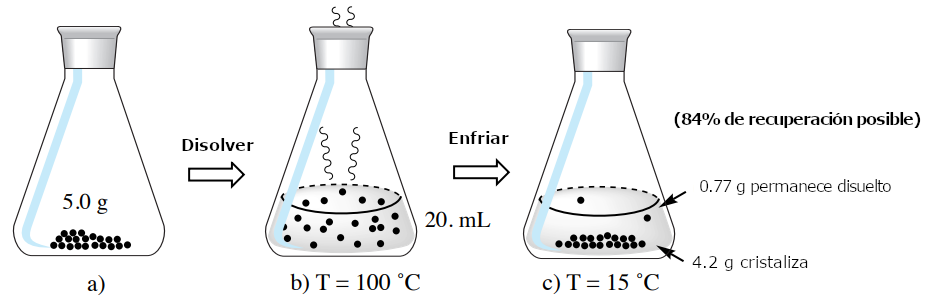
Cuando el ácido 2-furoico se disuelve en 20 mL de agua caliente y se deja enfriar, el compuesto cristalizará ya que tiene una menor solubilidad en el disolvente frío. Lo ideal sería colocar la solución en un baño de hielo (0°C), pero como no se proporcionan datos de solubilidad a 0°C, imaginemos que la solución se enfría a 15°C. La solubilidad del ácido 2-furoico en esta agua fría es la siguiente
Este cálculo muestra que una parte del ácido 2-furoico permanecerá disuelta en el licor madre incluso cuando se coloque en el baño frío. Cualquier compuesto presente que supere esta cantidad cristalizará, en este caso 4,2 g de ácido 2-furoico (5,0 g-0,77 g). Obsérvese que, debido a la pérdida de material en el licor madre, la recuperación máxima teórica de este proceso es sólo del 84% (100×4,2 g/5,0 g).
A continuación, imagine que, en lugar de utilizar la cantidad mínima de disolvente caliente, utilizamos el doble de volumen de disolvente caliente (40 mL en este ejemplo). Los cálculos de este ejemplo se describen a continuación y se resumen en la figura 7.
Cuando se duplica el volumen de disolvente, la cantidad de material disuelto en el licor madre también se duplica, como se muestra en el siguiente cálculo.
En cambio, si una muestra de 5,0 g de ácido 2-furoico se disolviera en 40 mL (el doble de la cantidad mínima de disolvente caliente necesaria), sólo cristalizarían 3,5 g (5,0 g-1,5 g). La recuperación máxima teórica para este proceso es sólo del 70%.
Obsérvese que cuando se utiliza más disolvente que el mínimo, hay más compuesto soluble en el disolvente y se pierde en el licor madre, lo que conduce a una menor recuperación teórica.

Como se puede imaginar, también hay una cantidad de disolvente en la que se disuelve toda la muestra de 5,0g de ácido 2-furoico (en este caso 130 mL, véase el cálculo más abajo). Si se utilizaran 130 mL para la cristalización en lugar de la cantidad mínima de disolvente caliente, no se formaría ningún cristal cuando se enfriara a 15°C (0 % de recuperación). Por lo tanto, la cantidad de disolvente utilizada en la cristalización debe controlarse y restringirse cuando sea posible.
Para demostrar la importancia de utilizar la mínima cantidad de disolvente caliente, se cristalizaron dos muestras de benzil (cada una de aproximadamente 1,8 g) a partir de etanol caliente (Figura 8). La primera se disolvió en la cantidad mínima de disolvente caliente (aproximadamente 8 mL), y dio lugar a una recuperación del 92% tras la cristalización. El segundo se disolvió en aproximadamente el doble de cantidad de disolvente caliente (aproximadamente 15 mL) y dio lugar a una recuperación del 87%. recuperación. El perfil de solubilidad del benzil condujo a una excelente recuperación en ambos ensayos, pero la recuperación se vio algo comprometida cuando se utilizó un exceso de disolvente.

Para más información Using the Minimum Amount of Hot Solvent
Como citar este artículo:
APA: (2021-05-19). Teoria de la cristalización. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/teoria-de-la-cristalizacion/
ACS: . Teoria de la cristalización. https://quimicafacil.net/tecnicas-de-laboratorio/teoria-de-la-cristalizacion/. Fecha de consulta 2024-07-27.
IEEE: , "Teoria de la cristalización," https://quimicafacil.net/tecnicas-de-laboratorio/teoria-de-la-cristalizacion/, fecha de consulta 2024-07-27.
Vancouver: . Teoria de la cristalización. [Internet]. 2021-05-19 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/teoria-de-la-cristalizacion/.
MLA: . "Teoria de la cristalización." https://quimicafacil.net/tecnicas-de-laboratorio/teoria-de-la-cristalizacion/. 2021-05-19. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net