Actualizado en enero 9, 2024
Tiempo de lectura estimado: 13 minutos
Se pueden emplear diversas formulaciones químicas para hacer tinción química de una placa de TLC o cromatografía en capa delgada. Estas técnicas se consideran destructivas ya que el compuesto se convierte en algo nuevo después del proceso.
Hay una variedad de métodos de visualización destructivos que pueden convertir los compuestos incoloros de una placa de TLC en tinciones de color. Una placa se rocía o se sumerge en un reactivo que sufre una reacción química con un compuesto de la placa de TLC para convertirlo en un compuesto coloreado, permitiendo que la tinción se vea a simple vista.
Dado que en el proceso se produce una reacción química, es común calentar suavemente una placa después de su exposición al reactivo para acelerar la reacción, aunque esto puede ser innecesario con algunas tinciones.
No todos los compuestos pueden visualizarse con todos los reactivos si no reaccionan juntos, y las tinciones suelen estar diseñadas para funcionar sólo con determinados grupos funcionales. La tinción específica debe elegirse en función de la presunta estructura de los compuestos que se desea visualizar.
Procedimiento general de tinción

Tiempo necesario: 20 minutos
Procedimiento de tinción
Mientras se usan guantes y se sostiene la placa de TLC con unas pinzas en una campana extractora, sumerja rápidamente la placa dentro y fuera del frasco de inmersión química para que la tinción cubra el área donde el disolvente viajó en la placa (Figura 1b).
Deje que el exceso de líquido gotee de la placa durante unos segundos y luego limpie la parte posterior de la placa con una toalla de papel (Figura 1c).
Caliente suavemente la placa para desarrollar las tinciones. Preferiblemente utilice una pistola de calor (Figura 1d), pero también se puede utilizar una placa calefactora (Figura 2, la carbonización es común).
Si usa una pistola de calor, sostenga la placa de TLC con pinzas y ondee la pistola de calor hacia adelante y hacia atrás en la parte delantera de la placa. El ajuste «alto» puede ser usado al principio, con el ajuste en «bajo» si la placa comienza a carbonizarse.
Nota de seguridad: Las pistolas de calor no son simples secadores de pelo, y pueden calentarse bastante. Tengan cuidado de no tocar la boquilla, y recuerden que se mantiene caliente por mucho tiempo después de que el calentamiento ha cesado. Las boquillas calientes pueden incluso estropear los bancos, así que ten cuidado al bajar el aparato.
Si utiliza una placa caliente, coloque la placa de TLC en la superficie caliente (colocada entre baja y media-baja, y cubierta con papel de aluminio para evitar que los residuos de la inmersión manchen la superficie de la cerámica). Periódicamente mueva la placa para distribuir el calor.Una placa de TLC no se puede someter a otra técnica de revelado después de usar una tinción.
Anuncio

Tinción de p-Anisaldehído/vainillina
La tinción con p-anisaldehído y vainillina son de uso general, y funcionan para muchos nucleófilos fuertes y débiles (alcoholes, aminas), y para muchos aldehídos y cetonas. No funcionan con alquenos, aromáticos, ésteres o ácidos carboxílicos. Las placas de TLC necesitan ser calentadas ligeramente, y desarrollarán un fondo de color rosa claro a rosa oscuro.
En la figura 3 se muestra una TLC de cuatro muestras visualizadas con tres técnicas diferentes. La placa se visualiza con luz ultravioleta (Figura 3b), tinción de p-anisaldehído (Figura 3c) y tinción de vainillina (Figura 3d). La 4-heptanona (carril #1) y la acetofenona (carril #2) mostraron coloraciones similares utilizando las dos tintas.
El benzoato de etilo (carril #4) no reaccionó a ambas. El cinamaldehido (carril #3) era reactivo al p-anisaldehído, pero no a la vainillina, mientras que su impureza (ácido cinámico, en la línea de base del carril #3) mostraba el comportamiento opuesto.

Preparación (p-anisaldehído): 135 mL de etanol absoluto, 5mL de H2SO4 concentrado, 1,5mL de ácido acético glacial y 3,7 mL de p-anisaldehído. Esta tinción es susceptible de degradación por la luz, por lo que debe guardarse envuelta en papel de aluminio (Figura 4e), idealmente en el refrigerador cuando no se utilice.
En comparación con otras tinciones, esta tinción tiene una vida útil algo corta (aproximadamente medio año). La tinción será al principio incolora (Figura 4a), pero con el tiempo se volverá de color rosa claro y luego oscuro (Figura 4b-d). La tinción es menos potente cuando se oscurece, pero a menudo sigue siendo utilizable.
Nota de seguridad: utilice guantes mientras use esta solución altamente ácida.
Preparación (Vainillina): 250 mL de etanol, 15g de vainillina, y 2.5mL de H2SO4 concentrado. Esta tinción es sensible a la luz y debe ser almacenada envuelta en papel de aluminio en el refrigerador. Originalmente es de color amarillo claro, pero se oscurece con el tiempo (Figura 4f+g). Debe ser descartado si adquiere un color azul.
Nota de seguridad: usar guantes mientras se usa esta tinción altamente ácida.

Mecanismos de reacción
Las tinciones de p-anisaldehído y vainillina reaccionan de manera similar, y comúnmente se someten a reacciones de aldol y acetalización para producir compuestos altamente conjugados (y por lo tanto coloreados) en las placas de TLC.
Reacciones de Aldol
En las condiciones ácidas de la tinción, algunos aldehídos o cetonas pueden sufrir un tautomero de keto-enol, y el enol puede someterse a la adición nucleófila catalizada por el ácido a p-anisaldehído o a la vainillina a través de un mecanismo de aldol. La deshidratación del producto aldol (fomentada por el calentamiento de la placa de TLC), da como resultado un compuesto altamente conjugado (Figura 5d), por lo que las tinciones se colorean.
Por ejemplo, una placa de TLC que contiene acetofenona y benzofenona (como se ve con la luz UV, Figura 5a), se tiñe con tinciones de p-anisaldehído y vainillina. La acetofenona produjo una tinción de color con estas tinciones (Figuras 5b+c) mientras que la benzofenona no. La principal diferencia es que la benzofenona no puede formar un enol, o ser un nucleófilo del p-anisaldehído, por lo que la tinción no es reactiva.

Reacciones de acetalización
Algunos alcoholes reaccionan con tinciones de p-anisaldehído y vainillina mediante reacciones de acetalización. Una reacción propuesta de p-cresol con p-anisaldehído se muestra en la Figura 6b para producir un catión altamente conjugado, una posible estructura de la tinción rosa en la placa de TLC en el carril #2 de la Figura 6a. Esta estructura catiónica puede parecer inusual, pero es una estructura factible en las condiciones altamente ácidas de la tinción.

Tinción de Permanganato
El ión permanganato (MnO-4) es de un color púrpura profundo, y cuando reacciona con los compuestos de una placa de TLC (y se consume), la placa queda de color amarillo (Figura 7a). La tinción visualiza fácilmente los alquenos y alquinos al someterse a reacciones de adición (Figura 7d), y el cambio de color es a menudo inmediato con estos grupos funcionales.
El permanganato también es capaz de oxidar muchos grupos funcionales (por ejemplo, aldehídos, carril 1 de la figura 7c), por lo que algunos lo consideran una tinción universal. Es posible que se necesite calor para visualizar algunos grupos funcionales, y a menudo mejora el contraste entre las tinciones y el fondo. Se puede calentar (si es necesario) hasta que el color de fondo empiece a ser amarillo, pero un fondo marrón significa que la placa se ha sobrecalentado.

Preparación: 1,5g KMnO4, 10g K2CO3, 1,25 mL 10% NaOH (aq), y 200mL de agua. Nota de seguridad: usar guantes mientras se usa esta tinción, ya que el permanganato es corrosivo y teñira la piel de marrón.
Tinción de ácido fosfomolibdico
La tinción del ácido fosfomolibdico (PMA) es considerada por algunos como una tinción universal, capaz de visualizar una amplia variedad de compuestos (alcoholes, alquenos, yoduros de alquilo y muchos compuestos de carbonilo).
El reactivo amarillo-verde de PMA (Mo6+) oxida el compuesto en la placa mientras que él mismo se reduce a azul de molibdeno (Mo5+ o Mo4+). Se requiere un calentamiento vigoroso para desarrollar las tinciones, pero la placa se sobrecalienta cuando el fondo comienza a oscurecerse. Típicamente no hay diferenciación de color entre las tinciones, ya que la mayoría de los compuestos se visualizan como tinciones verdes o azules (Figura 8c).

Preparación: 5g de ácido fosfomolibdico en 500mL de etanol. La tinción es sensible a la luz y por lo tanto debe ser almacenada en un frasco bajo papel de aluminio. El reactivo es caro, pero la tinción tiene una vida útil muy larga (más de 5 años).
Tinción de cloruro de hierro (III)
La tinción de cloruro férrico (FeCl3) es muy específica y se utiliza principalmente para visualizar los fenoles (Ar-OH). También se pueden visualizar algunos compuestos carbonilos con alto contenido de enol. El Fe3+ forma complejos coloreados con los fenoles (a menudo de color azul claro), en el sentido general de lo que se muestra en la Figura 9c. La estructura real de estos complejos es objeto de debate6. La coloración se desvanece bastante rápido con esta tinción, por lo que las observaciones deben registrarse inmediatamente.
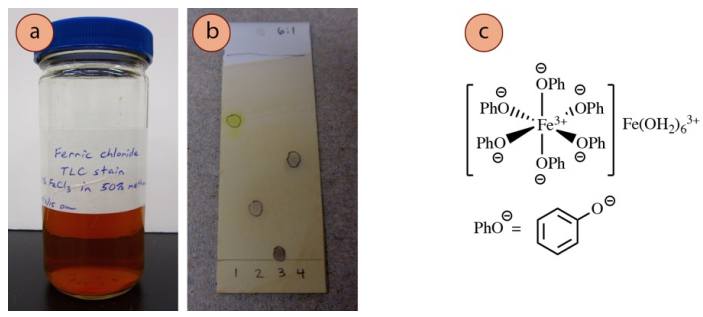
Preparación: 1% de FeCl3 en el agua y CH3OH (50% cada uno). Esta tinción tiene una alta vida útil (5+ años).
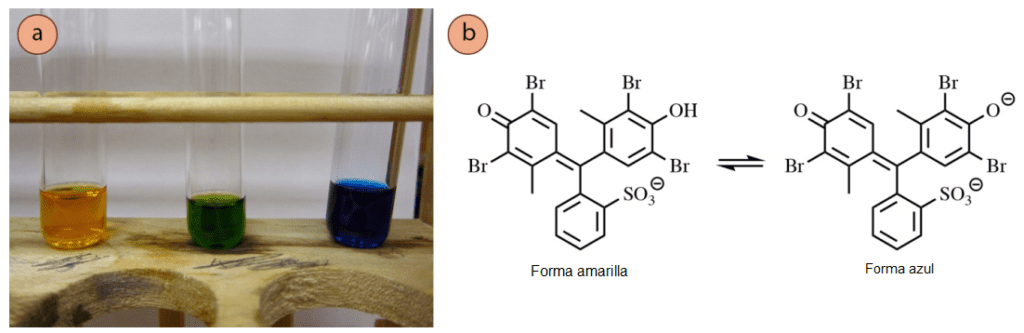
Tinción con verde de bromocresol
El tinte verde de bromocresol es específico para los compuestos ácidos, y debería poder visualizar los compuestos que producen una solución inferior al pH 5. La experiencia ha demostrado que los ácidos carboxílicos funcionan moderadamente bien (primer carril en la figura 10d) pero los fenoles son apenas visibles (indicados con una flecha en la figura 10d). En teoría, no es necesario calentar la placa después de la exposición a esta tinción, pero en la práctica a menudo mejora el contraste entre las tinciones y el fondo.

Preparación: 100 mL de etanol absoluto, 0,04 g de verde de bromocresol, y 0,10M NaOH (aq) gota a gota hasta que la solución pase de amarillo a azul (el verde funciona también, como en la Figura 10b).
Esta tinción utiliza un indicador ácido-base, que funciona de manera similar a la fenolftaleína. El verde de bromocresol es amarillo por debajo del pH 3,8 y azul por encima del pH 5,4 (Figura 11a). Cuando se observa un compuesto ácido en la placa, el ácido baja el pH y hace que el indicador cambie a la forma amarilla de pH más bajo (Figura 11b).
Para más información Stains for Developing TLC Plates
Como citar este artículo:
APA: (2020-10-21). Técnicas de revelado en TLC (II) – tinción química. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/tecnicas-de-revelado-de-tlc-ii-tincion-quimica/
ACS: . Técnicas de revelado en TLC (II) – tinción química. https://quimicafacil.net/tecnicas-de-laboratorio/tecnicas-de-revelado-de-tlc-ii-tincion-quimica/. Fecha de consulta 2024-07-27.
IEEE: , "Técnicas de revelado en TLC (II) – tinción química," https://quimicafacil.net/tecnicas-de-laboratorio/tecnicas-de-revelado-de-tlc-ii-tincion-quimica/, fecha de consulta 2024-07-27.
Vancouver: . Técnicas de revelado en TLC (II) – tinción química. [Internet]. 2020-10-21 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/tecnicas-de-revelado-de-tlc-ii-tincion-quimica/.
MLA: . "Técnicas de revelado en TLC (II) – tinción química." https://quimicafacil.net/tecnicas-de-laboratorio/tecnicas-de-revelado-de-tlc-ii-tincion-quimica/. 2020-10-21. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net